Die Chemilumineszenz von 1,2-Dioxetanen
Alle Stoffe mit einer Sauerstoff-Sauerstoff-Bindung werden Peroxide
genannt. Sie leiten sich formal vom Wasserstoffperoxyd (HOOH) ab. Es gibt
viele verschiedene offenkettige und cyclische Peroxide, mit zum Teil beträchtlicher
wirtschaftlicher Bedeutung. Cyclische Peroxide die einen aus vier Atomen
bestehenden Ring bilden, werden als 1,2-Dioxetane bezeichnet. Es gibt
verschiedene Methoden solche Kleinringheterocyclen zu erzeugen.
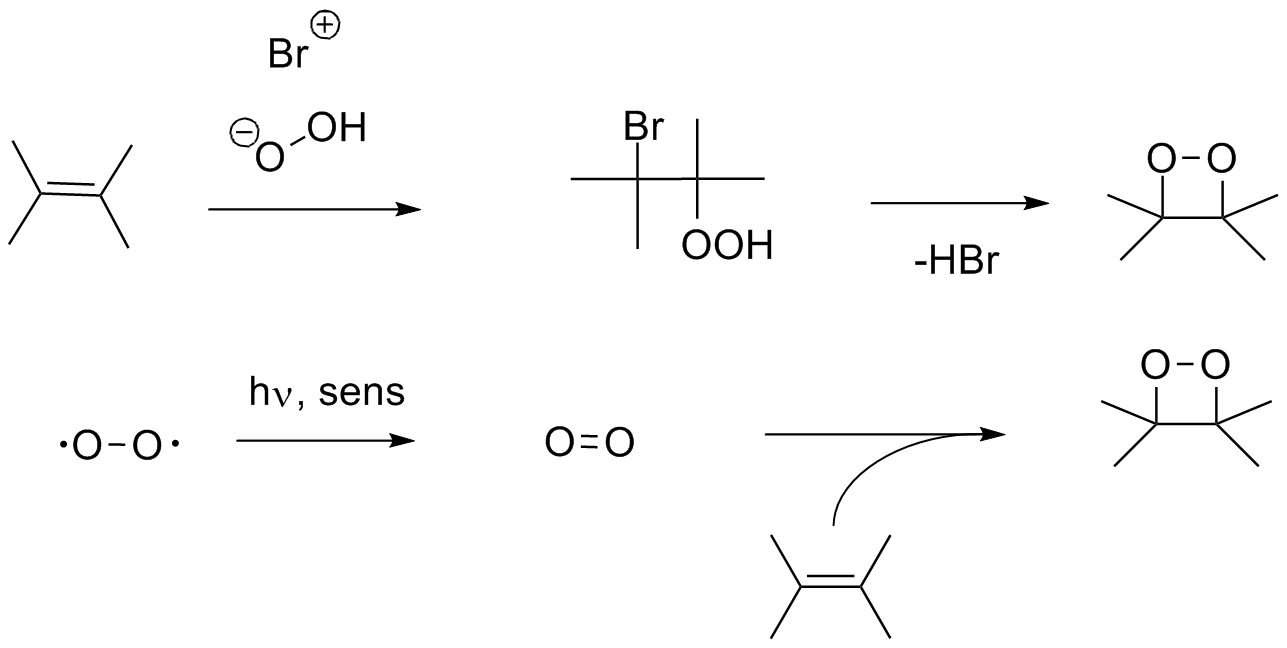
Die erste Methode ist die klassische Methode nach Kopecky (1). Ein Alken
wird durch eine Additionsreaktion zum Haloperoxid umgesetzt. Dieses lässt
sich in das Dioxetan überführen, wenn man mit einer Base HBr
abspaltet. Diese Methode funktioniert ausgezeichnet bei allen Alkenen mit
kleinen, sterisch wenig anspruchsvollen Substituenden R, oder wenn einer
oder zwei der Substituenden Wasserstoff sind. Bei sterisch anspruchsvollen
Substituenden verwendet man besser Methode zwei, bei der das Alken mit
photochemisch erzeugten Singulett Sauerstoff umgesetzt wird (
Arbeitsvorschrift).
In der Zwischenzeit gibt es natürlich auch einen technischen Fortschritt und vor Allem mit den
LED's auch neue Lichtquellen. Mit ein bischen Bastelei lassen sich so wunderbare kleine
Bestrahlungsapparaturen bauen aber auch richtige proffessionelle Bestrahlungsapparaturen konstruieren (12).
An den Arbeitsvorschriften ändert sich nichts.

Der Photoreaktor besteht aus einem doppelwandigen Glasgefäß wobei die äußere Schicht evakuiert ist. Man kann mit einem kleinen
Kühlfinger kühlen und über ein Gaseinleitungsrohr Sauerstoff einleiten. Die LED müssen an die Absorption des Sensibilisators angepasst sein.
Die grünen LED funktionieren mit Tetraphenylporphyrin, meinem bevorzugten Sensibilisator.
Im Gegensatz zu anderen cyclischen oder offenkettigen Peroxyden sind die
1,2-Dioxetane nicht stabil, das heisst sie zerfallen mehr oder weniger
schnell schon bei Raumtemperatur. Diese Reaktion ist eine Reaktion 1.
Ordnung und es gibt eine Halbwertzeit, die wiederum von den Substituenden
R abhängt. Obwohl inzwischen hunderte von Dioxetanen hergestellt
worden sind, gibt es noch keine Einigkeit darüber, welcher Effekt nun
eigentlich für die Stabilität bzw. Instabilität mancher
Dioxetane verantwortlich ist (3). Die Erfahrung zeigt, das Adamantyl- und
Isopropylreste Dioxetane stabilisieren können. Das stabilste bisher
hergestellte Dioxetan ist das Adamantylylidenadamantan-1,2-dioxetan, mit
einer Halbwertzeit von mehreren Jahren bei Raumtemperatur. Lässt man
in einem abgedunkelten Raum einige Kristalle dieses Dioxetans auf eine
etwa 200 °C heisse Heizplatte fallen, so kann man ein relativ helles
Aufblitzen beobachten und den Geruch von Adamantan-2-on wahrnehmen. Dieses
Experiment zeigt, dass beim Zerfall von 1,2-Dioxetanen elektronisch
angeregte Produkte erzeugt werden, die unter Aussendung von Licht in den
Grundzustand übergehen.
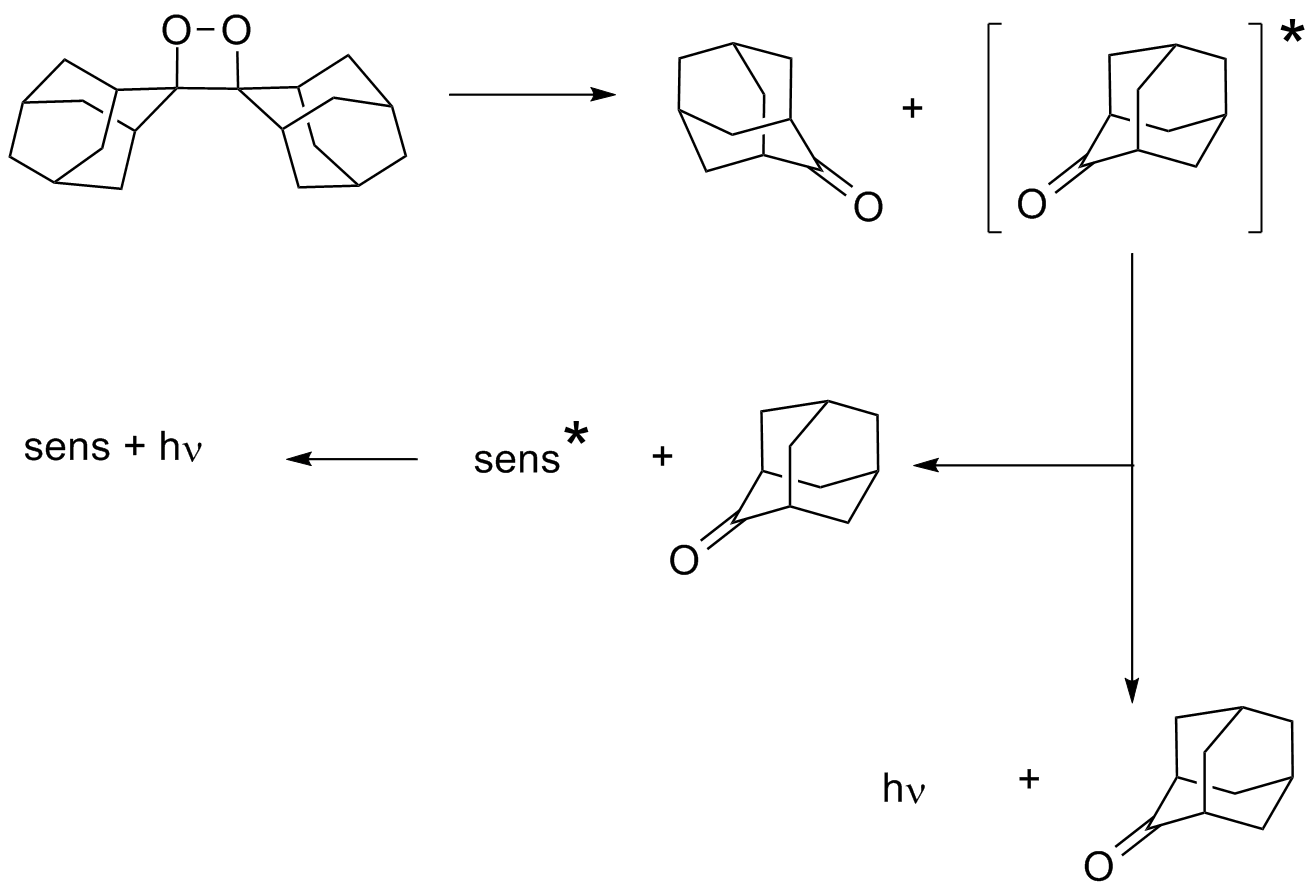
Diese angeregten Zustände werden gewöhnlich als triplett-Zustände
gebildet, das emittierte Licht entspricht demzufolge dem
Phosphoreszenzlicht. Durch Sensibilisatoren (Sens) wie z. B.
Diphenylanthracen lässt sich dieses Licht so verstärken, dass es
auch in Lösung mit blossem Auge sichtbar wird. Der thermische Zerfall
von 1,2-Dioxetanen bildet eine interessante Möglichkeit angeregte
Zustände zu erzeugen (4), die sonst nur photochemisch erhalten werden
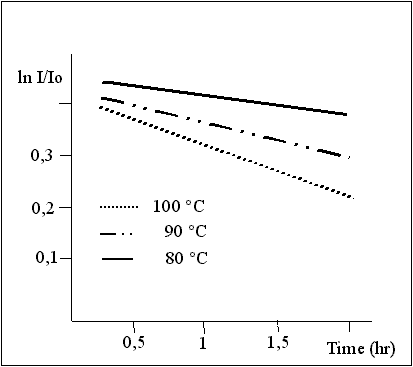
können (Photochemie ohne Licht). Misst man die abgegebene Lichtmenge
in Abhängigkeit von der Zeit, kann man die Geschwindigkeitskonstante
des thermischen Zerfalls und damit die Halbwertzeit des Dioxetanes
bestimmen. Messungen bei verschiedenen Temperaturen erlauben auch die
Bestimmung der Aktivierungsparameter. Eine alternative Methode zur
Bestimmung thermodynamischer und kinetischer Parameter ist die
Differential-Thermoanalyse.
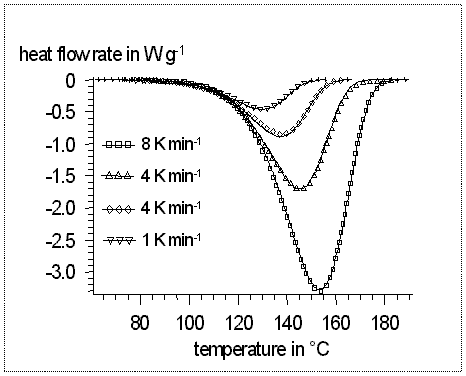
Bei dieser Methode werden die Dioxetane oder Lösungen der Dioxetane
in geschlossenen Gefäßen erhitzt und der Wärmefluss
gemessen. Es wird dabei ein bestimmtes Temperaturintervall mit
verschiedenen Aufheizraten und unterschiedlichen Dioxetankonzentrationen
erfasst. Auch hier können aus den erhaltenen Messwerten die
thermodynamischen und kinetischen Parameter der Reaktion ermittelt werden.
Der Vorteil dieser Methode besteht darin, dass eine größere
Datenmenge erhalten wird, was wiederum zu einer höheren Genauigkeit
der ermittelten thermodynamischen Parameter führt(5).
Die thermische Zersetzung von Dioxetanen lässt sich auch analytisch nutzen. Hierbei werden 1,2-Dioxetane in Nanopartikel gepackt
und über die Hülle des Nanopartkels mit Biomolekülen verbunden, die dann üben eine thermisch induzierte Chemilumineszenz identifiziert
werden können (6). Viel bedeutender ist allerdings, dass 1,2- Dioxetane
nicht nur thermisch zersetzt werden können, sondern der Zerfall auch
durch eine chemische Reaktion induziert werden kann. Dies ist ein Beispiel
für den CIEEL (
Chemically
Initiated
Electron
Exchange
Luminescence) Mechanismus der Chemilumineszenz [7].
Interessanterweise werden die entstehenden Carbonylverbindungen bei dieser
Art der Zersetzung im angeregten Singulett-Zustand gebildet. Hat eines der
Bruchstücke eine hohe Fluoreszenzquantenausbeute, so wird bei dieser
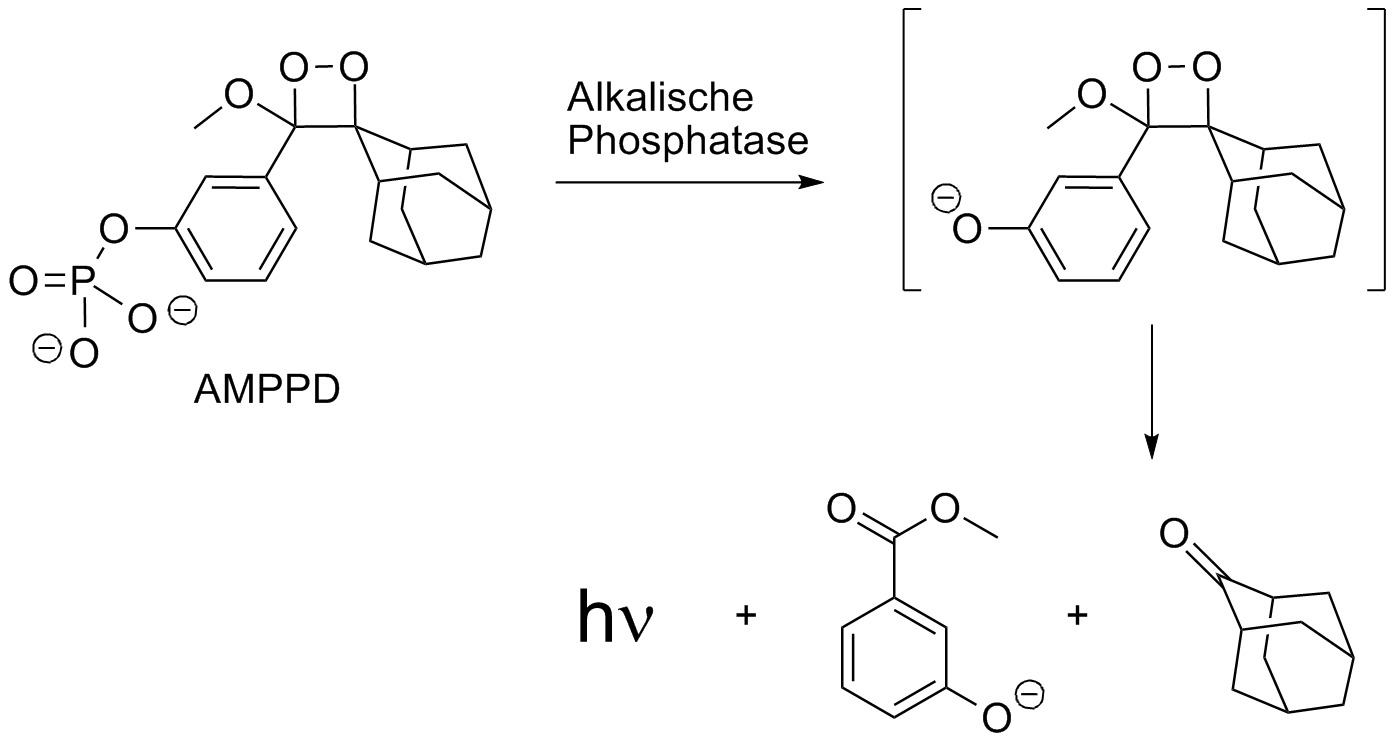
Reaktion richtig viel Licht erzeugt. Ein typisches Beispiel ist das AMPPD.
Wird durch das Enzym
Alkalische Phosphatase der Phosphatrest
abgespalten, so entsteht das entsprechende Phenolat-Anion. Ein
Elektronentransfer vom Phenolat zum Dioxetan induziert dessen Zerfall in
Adamantanon und dem angeregten Anion des 3-Hydroxybenzoesäuremethylesters.
Beim Übergang des angeregten Zustandes in den Grundzustand wird
schließlich ein Photon emittiert.
Mit diesem chemisch induzierten Zerfall von 1,2-Dioxetanen hat man die
ideale Nachweisreaktion gefunden. So lange das Enzym arbeitet und
ausreichend AMPPD vorhanden ist, wird ein konstanter Lichtstrom emittiert,
wobei die Lichtintensität proportional zur Enzymkonzentration ist. Da
sich heute selbst schwächste Lichtemissionen sicher und
reproduzierbar messen lassen, können bereits kleine Gruppen von
Enzymmolekülen nachgewiesen werden. Dies hat eine enorme Bedeutung in
der klinischen Diagnostik und in der biochemischen Analytik (8, 9), wo es
darum geht geringste Spuren chemischer Verbindungen aufzuspüren. Die
Alkalische Phosphatase wird dabei über einen Spacer an einen Antikörper
gekoppelt. Der Antikörper fischt selbst aus dem kompliziertesten
Stoffgemisch die Substanz heraus gegen die er gerichtet ist und markiert
sie mit der Alkalischen Phosphatase. Man braucht den Alkalische
Phosphatase/Antikörper/Substanz - Komplex nur noch abzutrennen und
kann durch Zugabe von AMPPD und Messung des Lichtes die Konzentration
bestimmen.

Das Bild zeigt die chemisch induzierte Lumineszenz eines 1,2-Dioxetanes. Das Licht
ist hell genug zum Lesen und hält, mit nahezu gleichbleibender Intensität, etwa 30 min an.
Man muss sich allerdings nicht mal die Mühe machen 1,2-Dioxetane mühsam herzustellen und zu isolieren um die Chemilumineszenz zu sehen.
Bei geeigneter Wahl der Ausgangsolefine kann man 1,2-Dioxetane in situ generieren und mit blossem Auge das Licht das beim Zerfall
frei wird sehen. Der Trick besteht darin, ein Dioxetan zu finden, dass sich schneller bildet als es wieder zerfällt und das gleichzeitig
eine helle Chemilumineszenz zeigt. Insbesondere der zweite Punkt ist problematisch da eine helle Chemilumineszenz nur bei einem Zerfall
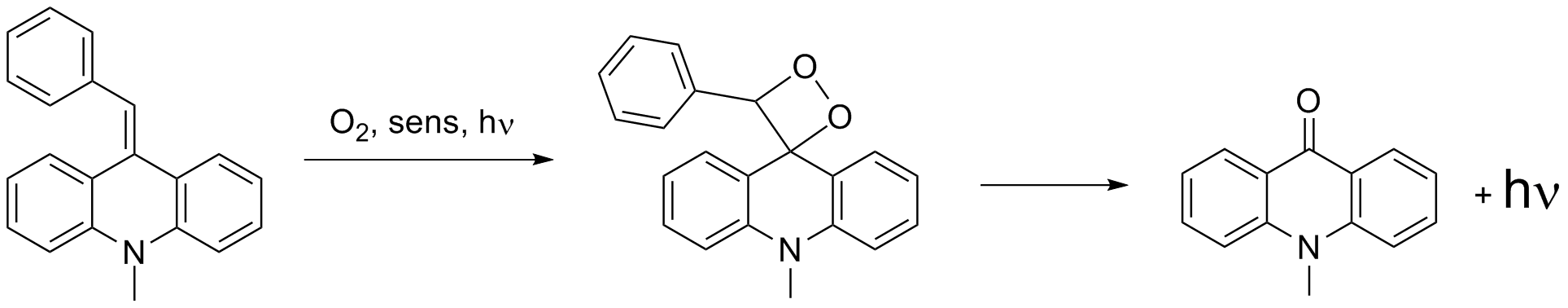
nach dem CIEEL - Mechanismus zu erwarten ist. Eine mögliche Lösung stellen Dioxetane auf der Basis von Acridinen dar. Das freie
Elektronenpaar am Stickstoff sorgt für einen intramolekularen Elektronentransfer und damit zu einer hellen CIEEL - Emission. Der
eigentliche Emitter ist das bei der Reaktion entstehende Acridon.

Das Olefin wird zusammen mit Methylenblau in Acetonitril gelöst (links) und mit einem roten Laser bestrahhlt (mitte). Nach abschalten
des Lasers sieht man die Emission des zerfallenden Dioxetans (rechts).
Der hier gezeigte Prozess ist schon einzigartig. Wir haben ihn "uphill energy conversion" genannt (10). Weil rotes Licht in blaues Licht
umgewandelt wird. Die dafür notwendige Energie stammt aus einer chemischen Reaktion. So einen Prozess kann man aber auch in der Analytik
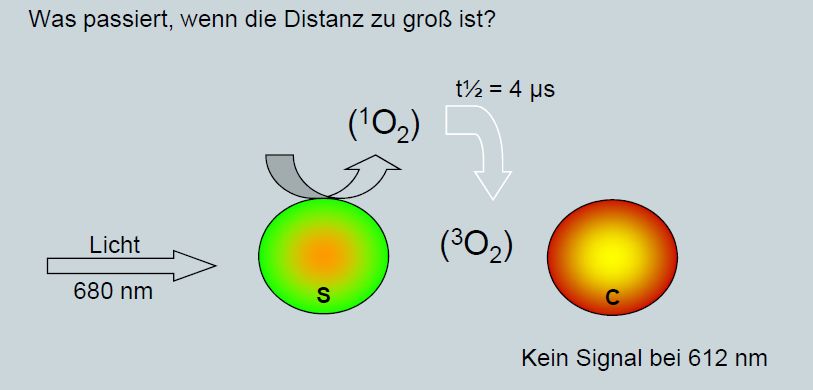
anwenden. Die Reaktion startet wenn ein geeignetes Molekül mit Singulett Sauerstoff reagiert. Die Lebensdauer von Singulett Sauerstoff
beträgt in wässrigen Medien etwa 4 µs und damit ist die mittlere freie Wegelänge begrenzt. Ob Licht erzeugt wird, hängt demzufolge
davon ab, ob sich das Olefin innerhalb der Diffussionsreichweite des Singulett Sauerstoffes befindet oder nicht. Die Methode heisst
deshalb LOCL
TM (local oxygen channeling luminescence) (11).
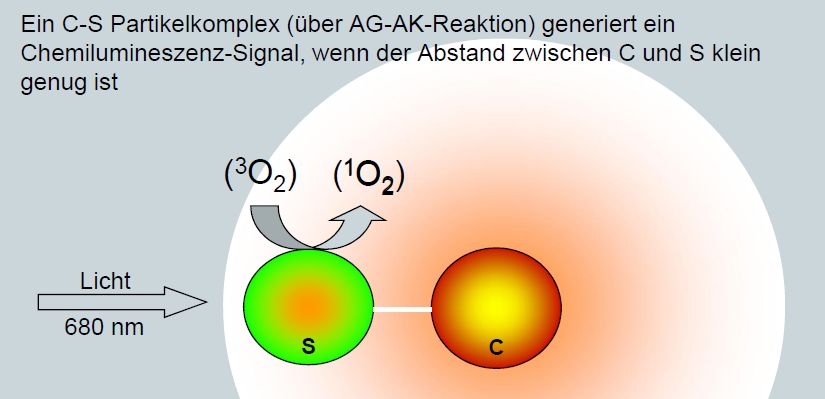
Ein Nanopartikel enthält den Sensitizer der bei Bestrahlung Singulett- Sauerstoff generiert. Der andere
Nanopartikel enthält ein geeignetes Olefin, welches mit Singulett-Sauerstoff zum Dioxetan reagiert, dass wiederum beim Zerfall Licht emittiert.
Befinden sich beide in relativer Nähe gibt es eine Reaktion und Licht wird emmittiert. Sind sie zu weit auseinander passiert nichts.
Literatur
- K. R. Kopecky, C. Mumford, Can. J. Chem. 47 (1969) 709-711
- G. B. Schuster, N. J. Turro, H.-C. Steinmetzer, A. P. Schaap, G.
Faler, W. Adam, J. C. Liu, J. Am. Chem Soc. 97 (1975) 7110-7118; W. Adam,
L. A. Encarnacion, K. Zinner, Chem ber. 116(1983) 839-846
- S. Wilsey, F. Bernardi, M. A. Robb, S. Murphy, W. Adam, J. Phys.
Chem. A, 103 (1999) 1569-1677
- W. Adam, Thermische Erzeugung elektronisch angeregter Moleküle,
Chemie in unserer Zeit 14 (1980) 45-55; W. Adam, G. Cilento, Viergliedrige
cyclische Peroxyde als Äquivalente angeregter Zustäde: Eine neue
Dimension der Bioorganischen Chemie, Angew. Chem. 95 (1983) 525-538
- H.-J. Flammersheim, D. Weiß and J. R. Opfermann, Journal of Thermal Analysis and Calorimetry, Vol. 77 (2004) 883-892
- A. Roda, M. Di Fusco, A. Quintavalla, M. Guardigli, M. Mirasoli, Anal. Chem. 2012, 84, 9913-9919
M. Lombardo, C. Trombini,
- Felipe A. Augusto, Glalci A. de Souza, Sergio P. de Souza J�unior, Muhammad Khalid and
Wilhelm J. Baader, Photochemistry and Photobiology, 89 (2013) 1299-1317
- S. Albrecht, H. Brandl, W. Adam, Chemilumineszenz-Reaktionen, Chemie
in unserer Zeit 24 (1990) 227-238
- S. Albrecht, H. Brandl, Th. Zimmermann, Chemilumineszenz, Hüthig Verlag, Heidelberg 1996
- Luiz Francisco Monteiro Leite Ciscato, Dieter Weiss, Rainer Beckert,
Erick Leite Bastos, Fernando Heering Bartolonia and Wilhelm Josef Baader, New J. Chem., 2011, 35, 773-775
- E. F. Ullmann et. al., Proc. Natl. Acad. Sci. USA 1994, 91, 5426-5430; Clin. Chem. 1996, 42, 1518-1526.
S. Albrecht, H. Brandl, L.F.M.L. Ciscato, D. Weiss, Th. Zimmermann, Chem. Unserer Zeit, 2011, 45, 24 - 30
- Dirk Ziegenbalg, Günter Kreisel, Dieter Weiß and Dana Kralisch, Photochemical and Photobiological Sciences, 4 (2014),
Advance Article, DOI: 10.1039/c3pp50302j


 Der Photoreaktor besteht aus einem doppelwandigen Glasgefäß wobei die äußere Schicht evakuiert ist. Man kann mit einem kleinen
Kühlfinger kühlen und über ein Gaseinleitungsrohr Sauerstoff einleiten. Die LED müssen an die Absorption des Sensibilisators angepasst sein.
Die grünen LED funktionieren mit Tetraphenylporphyrin, meinem bevorzugten Sensibilisator.
Der Photoreaktor besteht aus einem doppelwandigen Glasgefäß wobei die äußere Schicht evakuiert ist. Man kann mit einem kleinen
Kühlfinger kühlen und über ein Gaseinleitungsrohr Sauerstoff einleiten. Die LED müssen an die Absorption des Sensibilisators angepasst sein.
Die grünen LED funktionieren mit Tetraphenylporphyrin, meinem bevorzugten Sensibilisator.




 Das Bild zeigt die chemisch induzierte Lumineszenz eines 1,2-Dioxetanes. Das Licht
ist hell genug zum Lesen und hält, mit nahezu gleichbleibender Intensität, etwa 30 min an.
Das Bild zeigt die chemisch induzierte Lumineszenz eines 1,2-Dioxetanes. Das Licht
ist hell genug zum Lesen und hält, mit nahezu gleichbleibender Intensität, etwa 30 min an.

 Das Olefin wird zusammen mit Methylenblau in Acetonitril gelöst (links) und mit einem roten Laser bestrahhlt (mitte). Nach abschalten
des Lasers sieht man die Emission des zerfallenden Dioxetans (rechts).
Das Olefin wird zusammen mit Methylenblau in Acetonitril gelöst (links) und mit einem roten Laser bestrahhlt (mitte). Nach abschalten
des Lasers sieht man die Emission des zerfallenden Dioxetans (rechts).

 Ein Nanopartikel enthält den Sensitizer der bei Bestrahlung Singulett- Sauerstoff generiert. Der andere
Nanopartikel enthält ein geeignetes Olefin, welches mit Singulett-Sauerstoff zum Dioxetan reagiert, dass wiederum beim Zerfall Licht emittiert.
Befinden sich beide in relativer Nähe gibt es eine Reaktion und Licht wird emmittiert. Sind sie zu weit auseinander passiert nichts.
Ein Nanopartikel enthält den Sensitizer der bei Bestrahlung Singulett- Sauerstoff generiert. Der andere
Nanopartikel enthält ein geeignetes Olefin, welches mit Singulett-Sauerstoff zum Dioxetan reagiert, dass wiederum beim Zerfall Licht emittiert.
Befinden sich beide in relativer Nähe gibt es eine Reaktion und Licht wird emmittiert. Sind sie zu weit auseinander passiert nichts.