

Die Klasse der Insekten (Arthropoda) enthält Lebewesen mit Biolumineszenz in vier Ordnungen: Springschwänze (Collembola), Schnabelkerfe (Hemiptera), Käfer (Coleoptera) und Zweiflügler (Diptera). Von den 26 Ordnungen gibt es also gerade in vier Biolumineszenz und von den zahlreichen Unterordnungen und Familien der Käfer tritt Biolumineszenz nur bei den Leuchtkäfern (Lampyridae), den Klickkäfern (Elateroidae) und den Federleuchtkäfern (Phengodidae) auf 1. Insgesamt ist es also ein eher seltenes Phänomen. Ausserdem gibt es nur bei den Käfern genauere wissenschaftliche Untersuchungen zum Chemismus der lichterzeugenden Reaktion. Daher wissen wir auch, dass zumindest alle Käfer das selbe Biolumineszenzsystem verwenden. Die Startsubstanz ist das Luciferin I, welches enzymatisch oxydiert wird 2. Luciferin hat auch einer ganzen Klasse von Verbindungen den Namen gegeben, den Luciferinen. Analog verhält es sich mit der Luciferase die auch namensgebend für die ganze Klasse der Luciferasen war. Also Vorsicht! Nicht jedes Luciferin enthält auch das Luciferin und nicht jede Luciferase enthält auch die Luciferase! Im Allgemeinen wird für die Lichterzeugung folgender Reaktionsmechanismus angegeben, bei dem eine Carbonsäure (das Luciferin) mit einem Enzym (der Luciferase) reagiert.
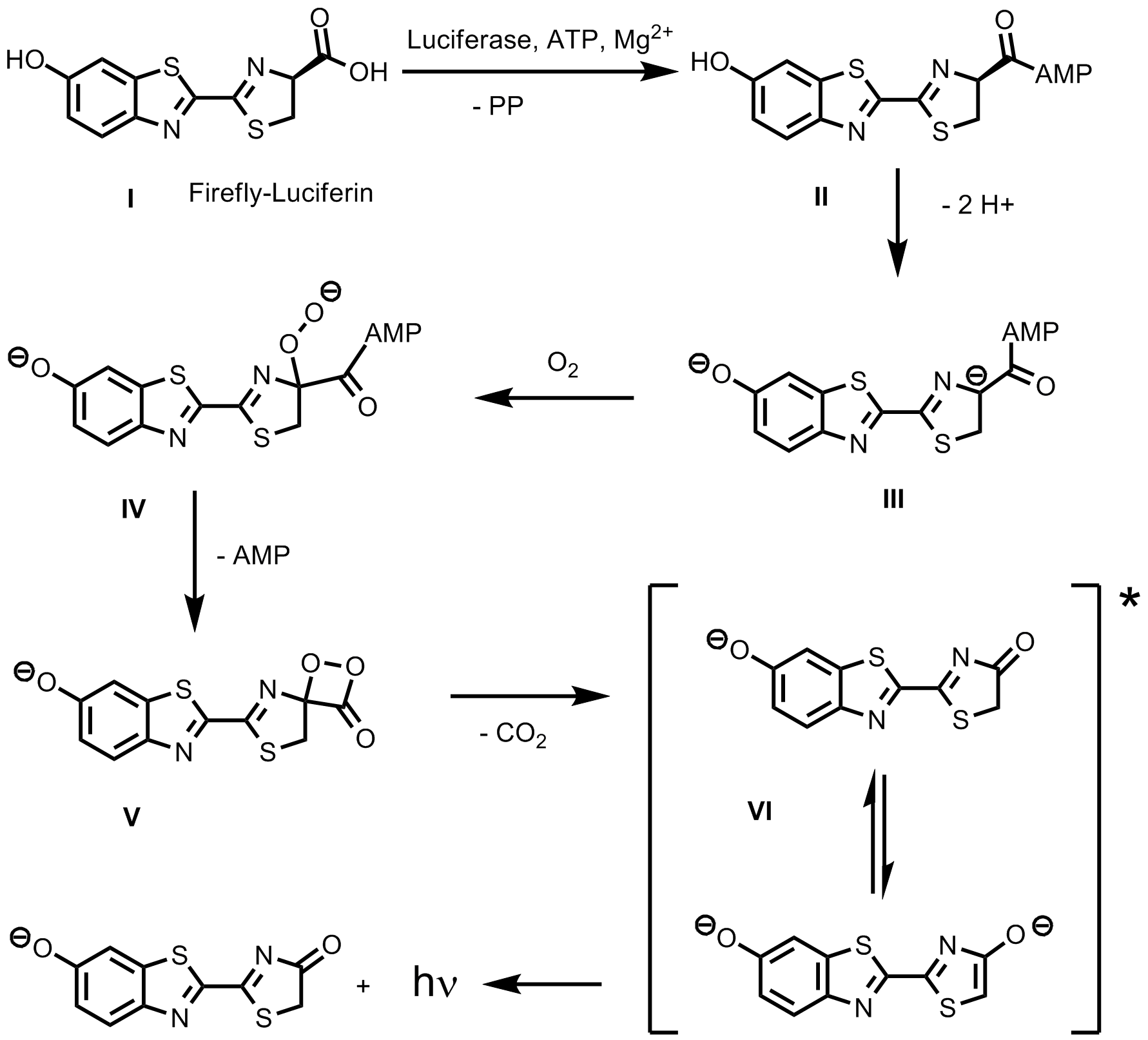
Bild 1: Mechanismus der Biolumineszenzreaktion von Leuchtkäfern
Dabei wird Luciferin I von einem Enzym, der Luciferase, mit Hilfe von ATP und Magnesiumionen in das gemischte Anhydrid II umgetzt. Dieses reagiert dann über das Anion III mit dem Sauerstoff der Luft zum Peroxidanion IV. Das daraus durch Cyclisierung (das ist letztlich die Veresterung eines gemischten Carbosäureanhydrids mit einem Peroxid) entstehende Peroxilacton V ist ein Schlüsselintermediat bei Chemilumineszenzreaktionen, konnte aber hier noch nicht sicher nachgewiesen werden. Dieser Kleinringheterocyclus spaltet Kohlendioxid ab und bildet das Oxiluciferin VI, das im Angeregten Zustand vorliegt. Unter Abgabe eines Photons geht das angeregte Oxiluciferin schließlich in den Grundzustand über. Obwohl es nur einen Emitter gibt, können manche Insekten neben dem gelb/grünen Licht auch rotes Licht erzeugen. Wie das genau passiert, ist letztlich noch nicht sicher geklärt. Eine Hypothese sagt, dass unterschiedliche Emissionsfarben durch Abspaltung eines Protons aus VI und anschließender Tautomerie zustandekommen 3. Umstritten ist auch der Schritt vom Anhydrid II zum Peroxyanion IV. Sauerstoff im Grundzustand ist ein Diradikal und die beiden Radikale können nicht so einfach verschwinden. In den meisten Mechanismusvorschlägen wird darüber hinweggesehen, was aber ein grundlegendes Problem der Reaktionen mit Sauerstoff ignoriert. Die Altermative ist ein Radikalmechanismus bei dem entweder direkt aus Verbindung II klassisch mit Sauerstoff ein Radikal erzeugt wird oder in dem ausgehend vom Anion III ein SET (single elektron transfer) stattfindet, über den das Anion IV gebildet wird. Durch Experimente mit einem Abfangreagenz konnte zumindest nahegelegt werden, dass ein Radikalmechanimus möglich ist 4.
Eines der Größten Rätsel war es lange Zeit, dass Luciferin eine nicht natürliche Aminosäure, das D-Cystein enthält. Erst vor wenigen Jahren konnte aufgeklärt werden, dass zunächst das natürliche L-Cystein eingebaut und dann durch ein System von zusammenhängenden Gleichgewichten isomerisiert wird 5.
Die Firefly-Lumineszenz hat in den letzten Jahren eine außerordentlich große Bedeutung erlangt. Zur Zeit zeichnen sich 4 Einsatzgebiete ab die hier getrennt aufgeführt werden, sich aber teilweise überschneiden:
Um mit Hilfe der Luciferin/Luciferase Reaktion Licht zu erzeugen, wird ATP benötigt. Die emittierte Lichtmenge ist dabei proportional zur in der Untersuchungslösung vorhandenen Stoffmenge an ATP. Auf Grund der hohen Quantenausbeute der Reaktion und der technisch ausgereiften Methoden der Lichtmessung hat man hier also eine ausserordentlich effektive und sensitive Methode zur quantitativen Bestimmung von ATP 6. Dies wird zum Beispiel bei Hygienekontrollen genutzt. Der Prüfer entnimmt eine Probe, die enthaltenen Bakterien werden in einer Pufferlösung zerstört und das freigesetzte ATP durch Luciferin/Luciferase Lumineszenz erfasst. Da man in etwa weiss wieviel ATP ein Bakterium enthält, bekommt man so über die Lichtintensität eine Aussage zum Bakteriengehalt der Probe.
Es gibt mittlerweile verschiedene Methoden um Fremdgene in Zellen einzuschleusen. Allen gemeinsam ist jedoch, dass man nie weiss ob die Übertragung funktioniert hat oder nicht, da man das übertragene Gen oft schlecht oder erst in einem viel späteren Entwicklungsstadium nachweisen kann. Deshalb bedient man sich sogenannter Reportergene. Das sind Gene die mit dem eigentlichen Ziel der Genübertragung nichts zu tun haben, sich aber leicht nachweisen lassen. Diese werden mit dem zu übertragenden Gen gekoppelt und zusammen eingeschleust. Im Falle der Luciferase bedeutet dies, dass nach einer erfolgreichen Genübertragung die entsprechende Zelle oder der Organismus nach Zugabe von Luciferin Licht emittiert 7.
Hier benutzt man ebenfalls Zellen, Bakterien oder Viren die das Luciferase-Gen tragen. Injiziert man zum Beispiel einer Ratte Salmonellen-Erreger die das Luciferase Gen tragen, so breiten sich die Erreger im Rattenkörper aus. Infusiert man eine Luciferinlösung so kann man diese Ausbreitung durch das entstehende Licht von aussen verfolgen, ohne die Ratte zu töten. Analog verhält es sich mit markierten Karzinomen bei denen man die Metastasenbildung und Verbreitung optisch durch das emitierte Licht verfolgen kann 8. Darauf aufbauend gibt es eine Methode in der genmanipulierte Viren als Diagnostika und gleichzeitig als Therapeutika für Tumore eingeetzt werden. Dieses Theragnostik genannte Verfahren befindet sich derzeit in der klinischen Erprobung und scheint ein sehr vielversprechendes und schonendes Verfahren zu sein.
Theoretisch wird der Mechanismus der Lichterzeugung bei chemischen Reaktionen sehr gut verstanden. Praktisch gibt es aber zur Zeit große Schwierigkeiten lichterzeugende Systeme zu Konzipieren und Konstruieren. Man befindet sich hier noch im Versuch/Irrtum Stadium. Dies betrifft auch das Luciferin/Luciferase System, wo zum Beispiel der Mechanismus der Enstehung von verschiedenen Farben noch umstritten ist. Diese Forschungen führten unsere Arbeitsgruppe beispielsweise zu den 4-Hydroxythiazolen die eine neue Gruppe von Hochleistungsfluorophoren bilden 9.
Luciferase kann aus den Körpern der amerikanischen Feuerfliege isoliert werden. Getrocknete "Fireflies" sind eine Handelsware und werden für etwa 31 € pro 1 g angeboten. Es gibt auch nur die Laternen oder getrocknetes Laternenpulver, je nach dem was man will. Die grosse Menge an Luciferase wird allerdings gentechnisch hergestellt.

Bild 2 und 3: Die Bilder zeigen getrocknete amerikanische Leuchtkäfer Photinus pyralis

Das Luciferin wird im allgemeinen totalsynthetisch hergestellt 10. Ausgangsstoff ist das 4-Methoxy-2-ammino-benzothiazol VII. Mit Natriumnitrit und unter sauren Reaktionsbedingungen erhält man daraus das Diazoniumsalz VIII. Dieses wird nach Sandmeyer mit einem KCN/CuCN Gemisch umgesetzt. Das Problem besteht darin, dass unter den sauren Reaktionsbedingungen, die das Diazoniumsalz braucht, Blausäure freigesetzt wird. Dies wird, zumindest teilweise, durch eine hohe Konzentration an Natriumhydrogencarbonat in der KCN Lösung verhindert. Trotzdem benötigt man einen riesigen Überschuß an Cyanid um einigermaßen vernünftige Ausbeuten an Nitril IX zu erhalten. Im nächsten Schritt wird der Methylether gespalten. Dies geschieht am Besten indem man das Nitril IX zusammen mit Pyridinhydrochlorid bei 175 ºC bis 220 ºC etwa 2 h schmilzt. Je nach Qualität des Ausgangstoffes IX und präparativem Geschick wird ein mehr oder weniger sauberes Produkt X erhalten, das nur noch mit D-Cystein zum fertigen Luciferin I umgesetzt werden muss. Diese Synthesesequenz ist nicht allzu kompliziert und kann von einem Studenten im Hauptstudium ohne weiteres bewältigt werden, wenn man sich traut mit großen Mengen Cyanid zu arbeiten.
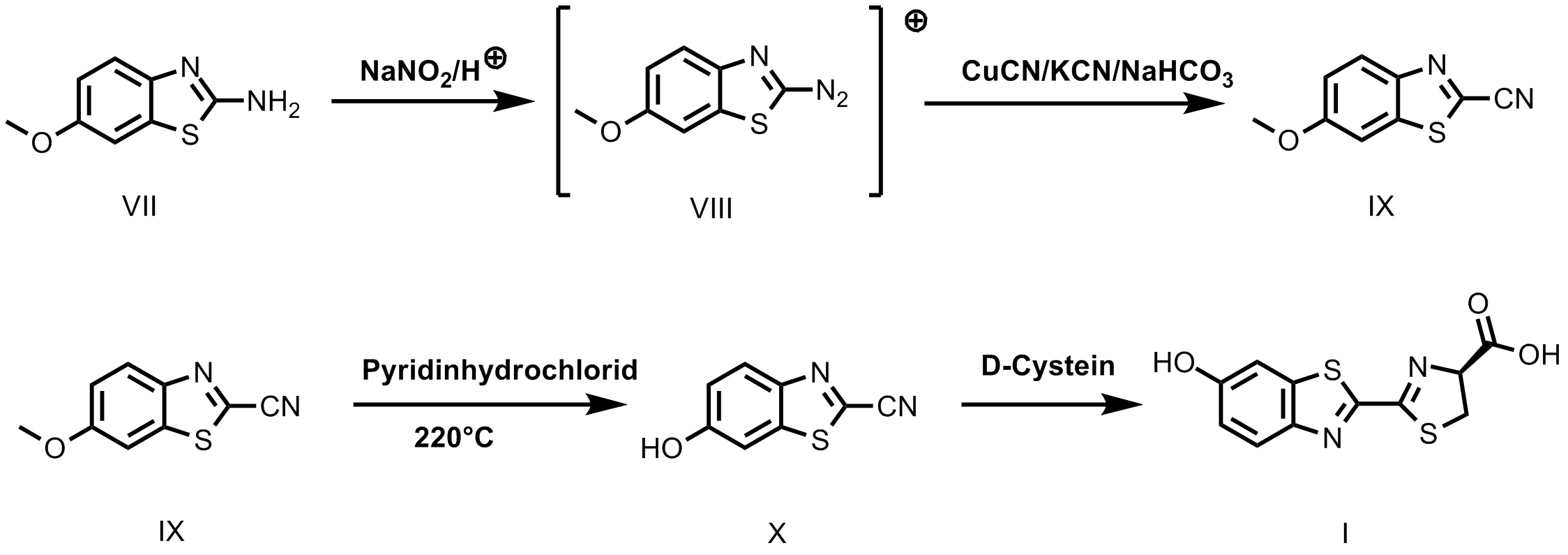
Bild 4. Sandmeyer- Reaktion, eine Möglichkeit um Luciferin herzustellen
Das Cyanobenzothiazol X ist eine Schlüsselsubstanz in der Luciferinsynthese, d. H. wenn man die erst mal hat, ist alles andere einfach. Es hat nicht an Versuchen gefehlt die Sandmeyer-Reaktion zu Vermeiden bzw. zu Umgehen. Eine interessante Variante bedient sich einer in Vergessenheit geratenen Synthese, der milden Thiolierung 11. Hierbei geht man vom p-Anisidin aus, das man mit Chloracetamid und Schwefel umsetzt, wobei man über mehrere Stufen schließlich das gewünschte Nitril erhält. Das sieht erst einmal kompliziert aus, aber man benötigt keine exotischen Chemikalien, keine extremen Reaktionsbedingungen und kann alle Produkte Umkristallisieren.
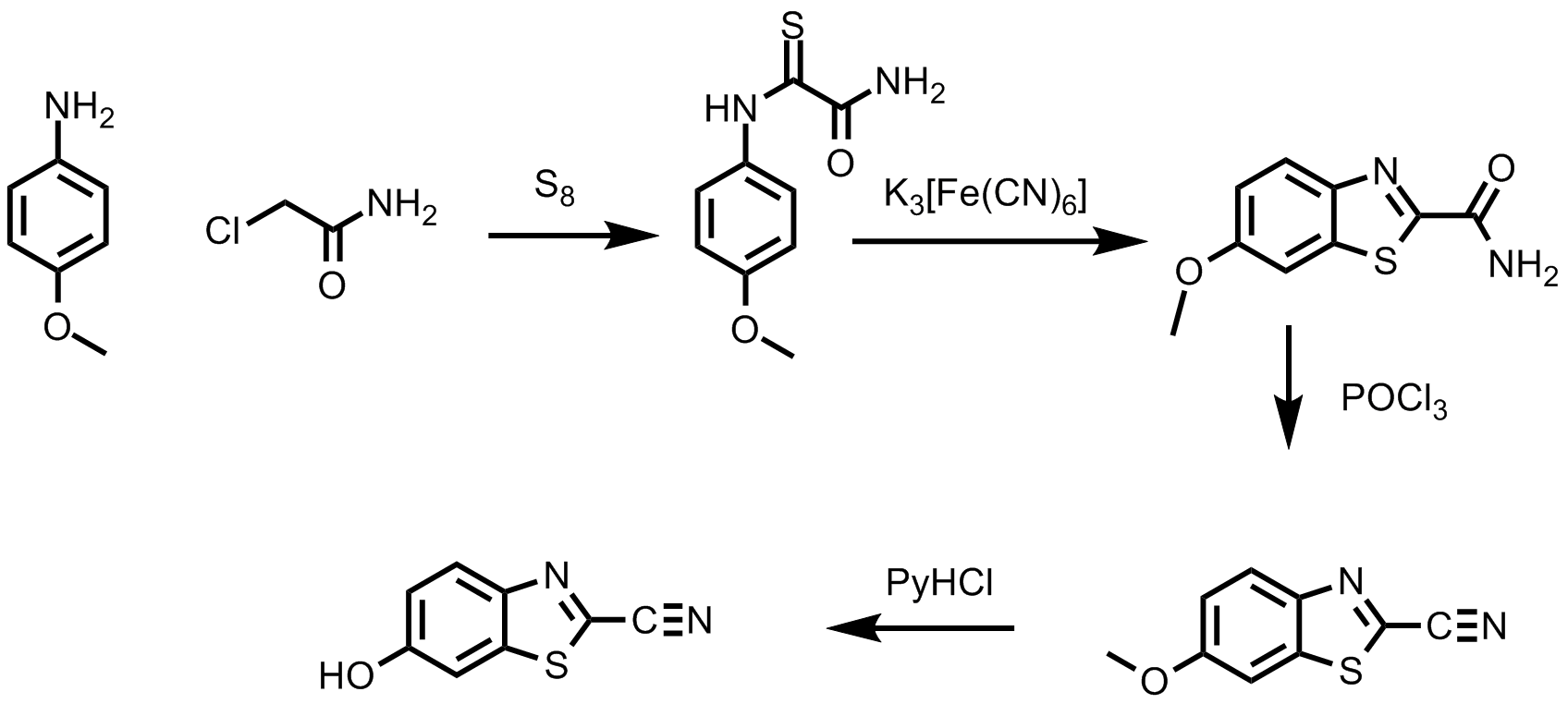
Bild 5. Die milde Thiolierung, eine schöne Methode zur Herstellung der Luciferinvorstufe
Es gibt immer wieder Anfragen warum man denn so ein gut funktionierendes System nicht für die technische Lichterzeugung einsetzt. Das Problem ist dabei, dass es sich um Licht handelt, welches bei einer chemischen Reaktion entsteht. Dafür benötigt man Chemikalien und produziert Chemikalienabfall. Das Glühwürmchen hat das Problem nicht, da es das bei der Reaktion entstehende Oxiluciferin wiederaufbereitet und auch nicht lage lebt. Das könnten wir theoretisch auch aber dafür brauchen wir noch mehr Chemikalien und produzieren noch mehr Abfall. Man könnte theoretisch das gesamte Lichterzeugende System in einen Organismus einbauen und den als Lichtquelle benutzen aber auch der muss sich ernähren und produziert Abfälle die entsorgt werden müssen. Alles in Allem benötigt man ein funktionierendes Biotop mit Primärproduzenten, Konsumenten und Destruenten wobei ein Glied dann für uns Licht erzeugen würde. Es gab die Idee das Luciferin/Luciferase System in Bäume einzubringen und die als Strassenbeleuchtung zu verwenden. Wollen Sie genmanipulierte Bäume als Strassenbeleuchtung vor Ihrem Haus stehen haben?
Wer das Licht der Glühwürmchen selbst einmal erzeugen und sehen möchte, muss sich dafür nur ein paar Chemikalien besorgen 12 :
Versuchsdurchführung: 5 ml Lösung 1, 0,5 ml Lösung 2 und 0,5 ml Lösung 3 werden miteinander gemischt. Dabei ist noch keine Lichtemission zu beobachten. Nach Zugabe von Lösung 4 startet die Biolumineszenzreaktion mit der Emission von gelbgrünem Licht. Die Intensität ist abhängig von der ATP Konzentration. Man darf nicht zuviel erwarten, das Licht ist gut zu sehen aber auf Grund der niedrigen Kontzentrationen und kleinen Stoffmengen nicht besonders eindrucksvoll