

Eine der beeindruckendsten und schönsten Reaktionen bei denen Licht emittiert wird, ist die sogenannte Peroxioxalat - Chemilumineszenz. Sie wurde erstmals von Chandros gesehen und beschrieben 1. Hierbei wird im ersten Schritt Oxalsäure oder ein Oxalsäurederivat mit Waserstoffperoxid oxidiert. Dabei entstehen energetisch angeregte Reaktionsprodukte, die ihre Energie auf einen zugesetzten Farbstoff übertragen und diesen zur Lumineszenz anregen. Das bei der Reaktion entstehende Licht kommt also nicht vom Oxalsäurederivat, sondern vom Farbstoff. Der Farbstoff sollte eine möglichst hohe Fluoreszenzquantenausbeute haben und darf sich natürlich mit Wasserstoffperoxid nicht zersetzen. Ansonsten sind der Auswahl fast keine Grenzen gesetzt, so dass sich nahezu alle Emissionsfarben erzielen lassen. Schwieriger ist es schon mit der Oxalsäurekomponente. Hier wurden in den vergangenen Jahrzehnten hunderte verschiedene Komponenten synthetisiert und getestet. Die besten Ergebnisse wurden mit Oxalsäure-bis-2,4,6-trichlorphenlester (TCPO) I und Oxalsäure-bis-2,4-dinitrophenylester (DNPO) II erzielt. Diese Verbindungen lassen sich leicht aus Oxalsäuredichlorid und den entsprechenden Phenolen herstellen , sind allerdings auch über den Chemikalienhandel erhältlich.
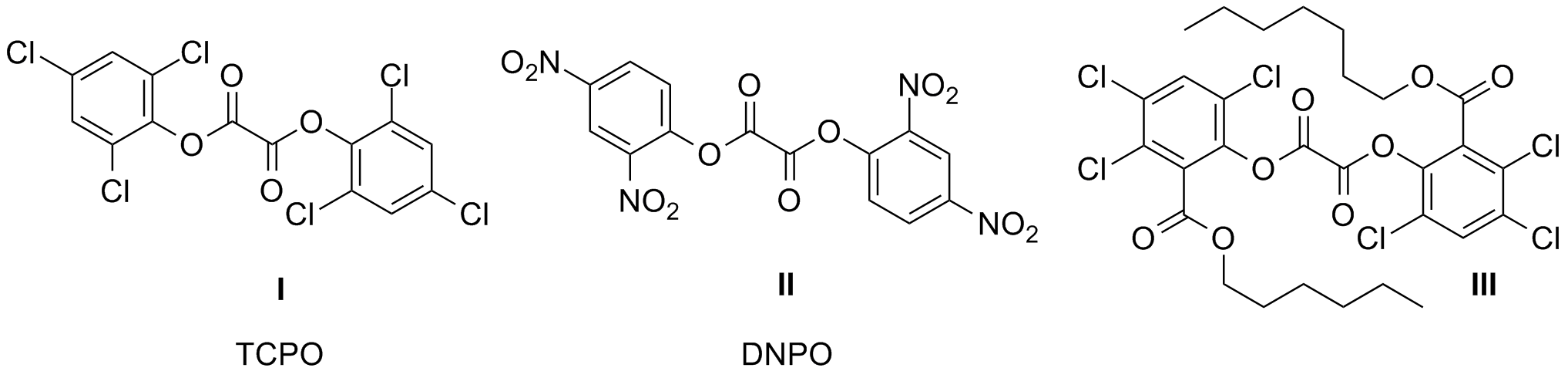 Abb. 1: Typische, für die Peroxioxalat Chemilumineszenz verwendete Oxalsäureester
Abb. 1: Typische, für die Peroxioxalat Chemilumineszenz verwendete Oxalsäureester
Für Experimente und Schauversuche reichen die Ester I und II aus, aber für komerzielle Zwecke, z. B. in Knicklichtern ist die Löslichkeit in org. Lösungsmitteln zu gering. Was hier eingesetzt wird, sind Oxalester der Salicylsäure III. Diese wird vorher Chloriert und mit einem langkettigen Alkohol verestert um die Löslichkeit zu verbessern. Zum Mechanismus der Reaktion gibt es eingehende Untersuchungen, sowohl über die Kinetik als auch über auftretende Zwischenprodukte. Einen Übersichtsartikel über die Peroxyoxalat Chemilumineszenz mit einer ausführlichen theoretischen und mechanistischen Einführung bietet die Zeitschrift ARKIVOK 2. Aus dem Oxalsäureester II wird mit Wasserstoffperoxid und unter Abspaltung der phenolischen Reste ein reaktives Zwischenprodukt gebildet, welches dann die Energie auf den Farbstoff überträgt. Das weiss man schon lang, aber der Nachweis dass es sich bei diesem Zwischenprodukt um das Peroxilacton IV handelt, ist erst vor wenigen Jahren gelungen und stellt eine echte wissenschaftliche Meisterleistung dar 3. Die Übertragung der Anregungsenergie erfolgt nach dem CIEEL-Mechanismus (chemically initiated electron exchange luminescence) und ist daher nicht ganz so einfach wie er in der untenstehenden Graphik angedeutet wird. Im Prinzip gibt es eine direkte Wechselwirkung zwischen dem energiereichen Zwischenprodukt und dem Emitterfarbstoff. Die Emissionsfarbe wird daher immer vom zugesetzten Fluoreszenzfarbstoff bestimmt.
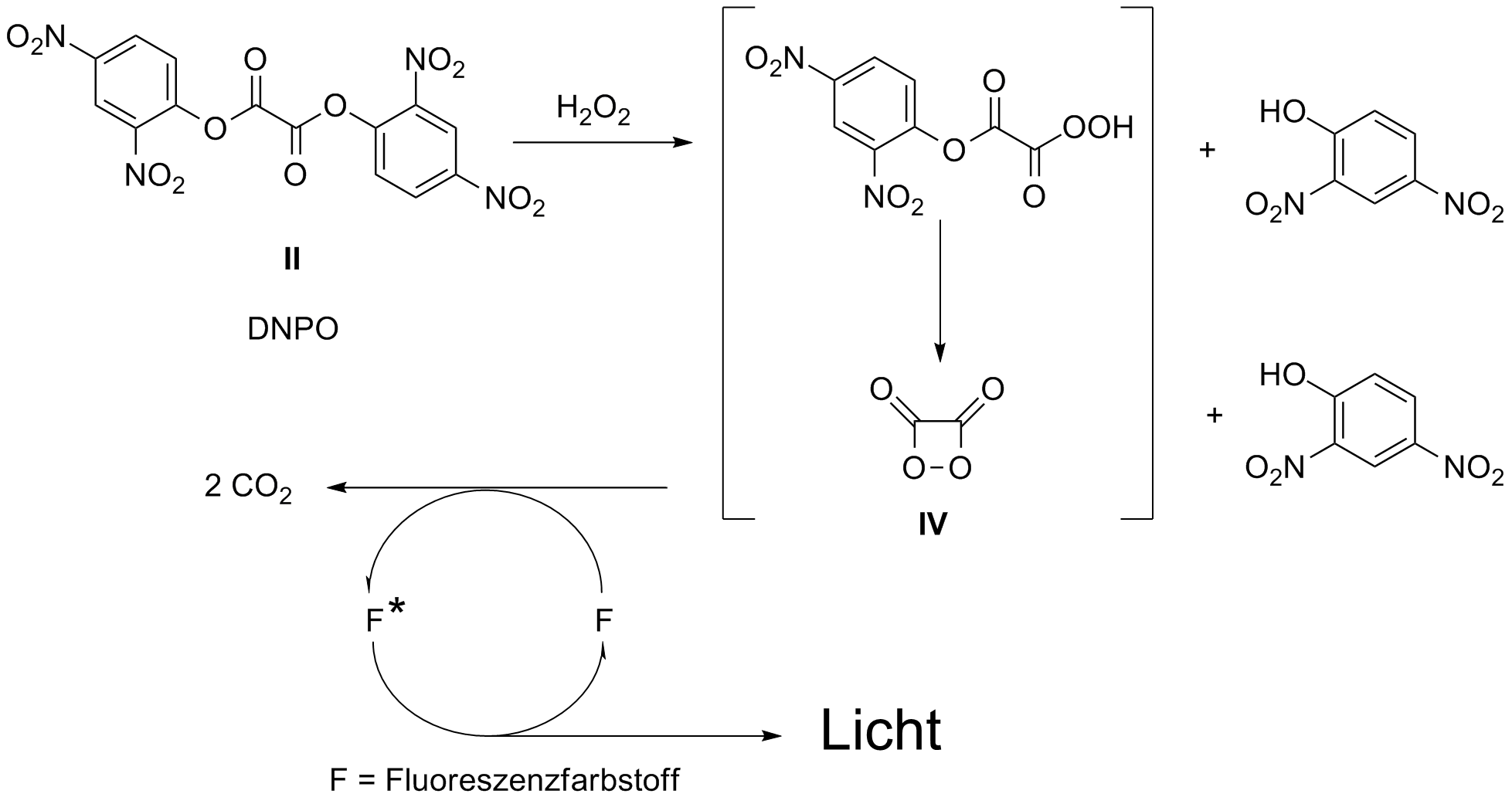
Abb. 2: So stellt man sich den Ablauf der Peroxioxalat Chemilumineszenz vor
Da der Farbstoff bei der Reaktion nicht verbraucht wird, genügen schon geringe Konzentrationen um ein eindrucksvolles Leuchten zu erzielen. Trotzdem dass es sich um einen intermolekularen CIEEL- Mechanismus handelt, sind die Quantenausbeuten sehr hoch, bis zu 30%. Das macht die Reaktion zu einer der hellsten und effektivsten Chemilumineszenzreaktion überhaupt. Es gibt nur eine Einschränkung und die bildet das Lösungsmittel. Die Reaktion funktioniert nur in wasserfreien Lösungsmitteln, z. B. in Essigsäureethylester oder Phthalsäuredibutylester, richtig gut. Es gibt zwar eine Nachweisreaktion von Porphyrinen in Urin 4 auf Basis der Peroxioxalat Chemilumineszenz, allerdings konnte sie sich gegenüber herkömmlichen Methoden nicht behaupten. Das Zentrum der Erforschung dieses Chemilumineszenzsystems befindet sich derzeit an der Universität Sao Paulo, in der Arbeitsgruppe von Prof. W. J. Baader. Hier wird versucht, durch Synthese von postulierten Intermediaten, durch kinetische Untersuchungen und durch Erforschung verschiedener Farbstoffsysteme, genauere Informationen zum Mechanismus der Reaktion und der Energieübertragung zu erhalten 5.
Die Einschränkung der Reaktion bezüglich des Lösungsmittels hat natürlich auch praktische Konsequenzen für den der die Reaktion mal machen will. Da Wasserstoffperoxid meistens in einer 30% wässrigen Lösung zur Anwendung kommt, vermischt es sich natürlich schlecht mit Essigester oder anderen organischen Lösungsmitteln. Das gleiche gilt auch für die Hilfsbase die man zusetzen muss, um schwach alkalische Reaktionsbedingungen zu erhalten. Hier hilft man sich durch Zugabe eines Lösungsvermittlers, der sich sowohl im Wasserstoffperoxid als auch im org. Lösungsmittel löst. Eine typische Oxidatorlösung wird z. B. erhalten, indem man 1 g Natriumsalicylat (Hilfsbase) in 30 ml 30% Wasserstoffperoxid löst und diese Lösung noch einmal mit 30 ml tert.-Butanol (Lösungsvermittler) vermischt. Diese Oxidatormischung ist mehrere Stunden haltbar und kann in allen gängigen Lösungsmitteln eingesetzt werden. Zum Thema Lösungsmittel ist noch zu sagen, dass sich die Oxalsäureester auch in org. Lösungsmitteln schlecht lösen. Es bietet sich an, ein hochsiedendes Lösungsmittel mit einer hohen Viskosität einzusetzen, z. B. ein Phthalsäureester. In Phthalsäurediethylester oder Phthalsäuredibuylester kann man bei 80 ºC eine deutlich größere Menge an Oxalester lösen als in Essigester bei Raumtemperatur. Die höhere Konzentration, verbunden mit einer höheren Reaktionsgeschwindigkeit, führt zu einer besonders hellen Lichtemission die man schon bei Tageslicht sehen kann.

Peroxioxalat Chemilumineszenz in Essigester mit TCPO, Fluorophore sind Diphenylanthracen, bis-Phenylethinylanthracen und Rubren
Viele schöne Beispiele zur Peroxyoxalat Chemilumineszenz wurden von Ostr. Herbert Brandl (1947-2018) und Prof. Dr. Steffen Albrecht (1957 - 2012) entwickelt und sind heute echte Klassiker. Ein typisches Beispiel ist der " Dracula Tee ", der zeigt wie man mit relativ einfachen Mitteln einen schönen Lichteffekt erzeugen kann 6.
Wir füllen in ein Teeglas unter dem Abzug 100 ml Ethylacetat (Essigsäureethylester). Nun fügen wir 10 ml Wasserstoffperoxid und eine Teelöfffelspitze (ca. 0,5g) eines der obigen Oxalester (TCPO, DNPO) hinzu. Nach dem Umrühren mit dem Teelöffel taucht man einen Teebeutel (Pfefferminztee) in die Lösung. Sogleich erstrahlt im Dunkeln die ganze Lösung in einem wundervollen roten Licht. Das Leuchten ist dabei so stark, dass es selbst bei Tageslicht gut wahrnehmbar ist. Bei Verwendung von DNPO ist das Leuchten heller, aber von kürzerer Dauer als mit TCPO.

So muss ein "Dracula Tee" aussehen!
Der Farbstoff der für die Emission von rotem Licht verantwortlich ist, ist das Chlorophyll aus dem Pfefferminztee. Andere getrocknete Pflanzenteile funktionieren natürlich auch, aber keine fermentierten Stoffe wie etwa Schwarztee. Wenn die Reaktion nicht so funktioniert wie sie soll, liegt es meist an der Qualität des Tees, minderwertige Qualitäten geben nur wenig Licht da sie nur wenig extrahierbares Chlorophyll enthalten. Eine besonders gute Chlorophyll Quelle ist Kürbiskernöl. Einige Tropfen gelöst in Essigester geben eine schöne rote Chemiluminesznez. Eine ausgezeichnete Arbeit , vor Allem über die Synthese von Oxalestern aber auch über die Herstellung der entsprechenden Farbstoffe inclusive der ausführlichen Versuchsbeschreibungen, hat Herr Christopher Lebeau (Gymnasium Düren) in seiner Chemie-Jahresarbeit vorgelegt.
Es gibt natürlich viele Versuche die Einschränkungen bezüglich Lösungsmittel und Wasserstoffperoxid zu umgehen. Mit gutem Erfolg lässt sich z. B. die Wasserstoffperoxid Lösung durch Percarbonat aus Waschmitteln ersetzen. Percarbonat ist in vielen Vollwaschmitteln und vor Allem in Bleichmitteln in mehr oder weniger hoher Konzentration enthalten. Percarbonat ist ein Addukt aus 2 Mol Natriumcarbonat mit drei Mol Wasserstoffperoxid. In Gardienenbleichmitteln ist das Percarbonat in hoch konzentrier Form enthalten. Ausserdem enthalten diese Mittel einen Optischen Aufheller der für eine blaue Emissionsfarbe der Chemilumineszenz sorgt 7. Will man seinen eigenen Farbstoff zusetzen dann muss man auf "Reine Sauerstoffbleiche" umsteigen, das ist praktisch reines Percarbobat ohne Zusätze. Auch bei den verwendeten Sensibilisator Farbstoffen kann man auf Naturstoffe zurückgreifen. Blau hatten wir schon bei den Gardinenbleichmitteln. Orange erhält man durch Hypericin aus Johanniskrautblütenblättern. Man kann sie sammeln, trocknen und mit Essigester extrahieren, wenn amn sie braucht. Rot bekommt man natürlich aus Chlorophyll. Man muss nicht einmal Blätter extrahieren, Steirisches Kürbiskernoel ist die Chlorophyllquelle schlechthin. Aber vorsicht das Zeug ist hoch konzentriert, ein Tropfen genügt meistens schon. Bleibt noch der schwierigste Teil, das Lösungsmittel. Hier habe ich vieles ausprobiert aber Ester funktionieren einfach am Besten. Ein hochsiedender Ester ist der Biodiesel (Rapsölmethylester) und der lässt sich tatsächlich auch verwenden. Natürlich ist er relativ viskos und löst das TCPO nicht besonders gut aber er funktioniert und ist vollkommen untoxisch und nicht umweltgefährdend.
Arbeitsvorschrift 1: In einem Mörser verreibt man eine Spatelspitze TCPO mit etwa 5 ml Biodiesel. Dann gibt man 2 Spatelspitzen "Gardinenweiß" (Dr. Beckmanns) zu und reibt weiter. Es entwickelt sich eine schöne blaue Chemilumineszenz. Mitunter startet die Reaktion erst richtig, wenn man einen Tropfen Wasser zugibt.
Arbeitsvorschrift 2: In einem Mörser verreibt man eine Spatelspitze TCPO und eine geringe Menge Fluoreszenzfarbstoff (Rubren eignet sich besonders gut) mit etwa 5 ml Biodiesel. Dann gibt man 2 Spatelspitzen "Reine Sauerstoffbleiche" (Heitmanns) zu und reibt weiter. Es entwickelt sich eine schöne Chemilumineszenz, deren Farbe vom zugesetzten Farbstoff abhängt. Mitunter startet die Reaktion erst richtig, wenn man einen Tropfen Wasser zugibt.

In einem Mörser wurde TCPO mit Gardinenenweiß und Biodiesel verrieben
Im Rahmen eines Schülerprojektes haben wir nochmals versucht Aktivatoren und Lösungsmittel zu entschärfen. Ein Aktivator ist schon länger bekannt und das ist der Ester aus Oxalsäure und Vanillin (BVO, Bis-Vanillyloxalat). Er funktioniert, leuchtet aber deutlich weniger hell als z. B. TCPO. Dafür entsteht bei der Reaktion nur Vanillin und CO2 und das Endprodukt riecht demzufolge auch gut. Mit Biodiesel konnten wir keine Chemilumineszenz beobachten, aber durch systematische Suche und Ausprobieren sind wir auf den Malonsäurediethylester gestoßen. Das ist ein wichtiges Startmaterial in der Synthesechemie, wird aber normalerweise nicht als Lösungsmittel verwendet. Die wenigen H- und P- Sätze gehen auf die augenreizende Wirkung ein (bei Kontamination mit Wasser ausspülen). Eine Toxische Wirkung wurde erst ab 15 g/kg festgestellt. Durch den hohen Siedepunkt wird Malonester auch nicht eingeatmet, er wird in der Natur abgebaut und reichert sich nicht an. Wir haben also einen wenig effektiven Aktivator kombiniert mit einem nicht optimalen, aber dafür ungiftigen Lösungsmittel.
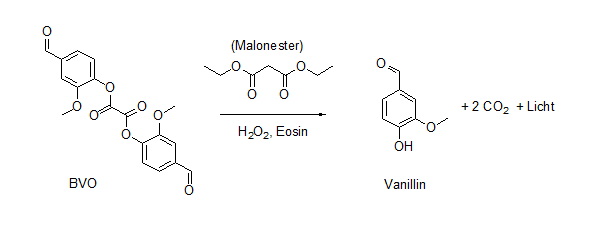 Reaktion von BVO mit Wasserstoffperoxid
Reaktion von BVO mit Wasserstoffperoxid
Arbeitsvorschrift 3: Das BVO wird mit Natriumsulfat und Kaliumcarbonat zu einem feinen Pulver zerrieben (19g Na2SO4, 1g K2CO3, 1g BVO). In einem Verschlossenen Gefäß ist diese Mischung lange haltbar. Sie reicht für mindestens 20 Versuche aus. In einem Mörser wird eine Spatelspitze dieser Mischung mit wenig Malonester und Farbstoff versetzt und kurze Zeit gerührt. Die Reaktion startet wenn 2-3 Tropfen Wasserstoffperoxid zugegeben werden und weiter gerührt wird.
Das Natriumsulfat entzieht dem Wasserstoffperoxid das Wasser, so dass es sich besser im Malonester löst. Auch hier sind nicht alle Farbstoffe geeignet. Mit Eosin wurde eine wirklich helle Chemilumineszenz beobachtet, die der mit TCPO in nichts nachsteht. Ein großer Vorteil ist, dass die angesetzte Mischung sehr sparsam mit der Aktivatorkomponente umgeht und nur extrem wenig Wasserstoffperoxid benötigt. Dazu gibt es auch ein Video. Ein zusätzlicher Vorteil des Systems liegt darin, dass keine weiteren Komponenten benötigt werden, kein tert-Butanol als Lösungsvermittler und kein Salicylat oder Imidazol als Reaktionsbeschleuniger. Es gibt auch keine Glasgeräte die zerbrechen können und hinterher wieder aufgewaschen werden müssen. Der Mörser ist stabil und sein Inhalt kann hinterher bedenkenlos mir Wasser ausgespült werden.