Chemilumineszenz mit Luminol
Das Luminol als organischer Feststoff wurde erstmals in einer Dissertation aus dem Jahr 1902 beschrieben [1]. Später
konnten Curtius und Semper die Synthese vereinfachen [2]. Sie konnten zwar eine blaue Fluoreszenz in saurer Lösung beobachten,
die in alkalischer Lösung auftretende Chemilumineszenz wurde von ihnen jedoch nicht entdeckt. Diese Entdeckung wurde erstmals im Forschungalaboratorium
der IG Farben gemacht (Lommel) aber nicht publiziert. Dies erfolgte erst 1928 durch H. H. Albrecht [3], von dem auch ein erster
Vorschlag zum Mechanismus der Chemilumineszenzreaktion stammt. In den folgenden Jahren wurden zahlreiche Derivate und Strukturmodifizierte
Verbindungen hergestellt und auf ihre Chemilumineszenz untersucht [4]. Luminol zählt bis heute, bezüglich der Lichtintensität, zu den Spitzenreitern.
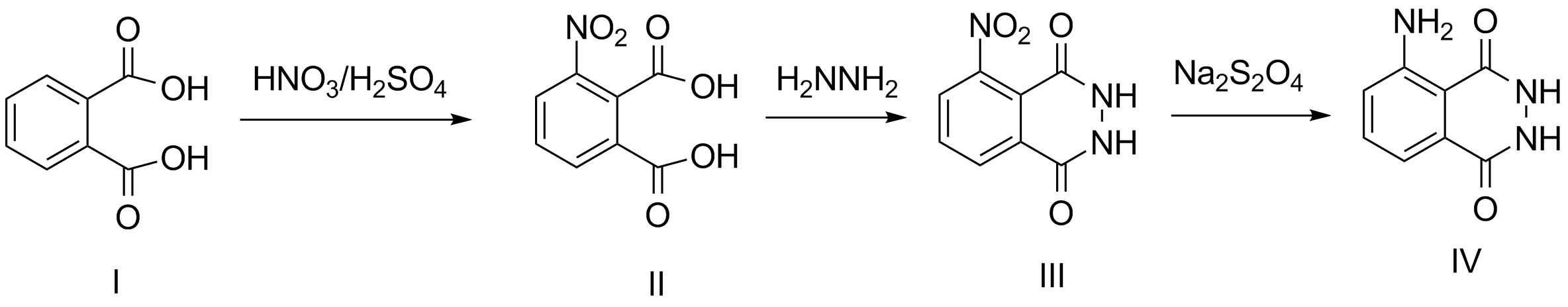
Auch an den Vorstellungen zum Reaktionsmechanismus hat sich kaum etwas geändert. Die Synthese erfolgt meist ausgehend von
Phthalsäure I. Diese wird mit Nitriersäure in 3-Nitrophthalsäure II überführt, welche wiederum mit Hydrazinhydrat das cyclische
Hydrazid III bildet. Die abschließende Reduktion liefert schließlich das 3-Amino-phthalsäurehydrazid (Luminol) IV in mehr oder weniger
reiner Form. Eine Arbeitsvorschrift ausgehend von o-Nitrophthalsäure findet man zum Beispiel bei
Lambdasyn
Ich habe die Synthese selbst ausprobiert und auch die entsprechende Menge Luminol erhalten. Es fällt als gelbes Pulver an. Man sollte
nur die Geduld aufbringen das Filtrat noch einige Tage stehen lassen. Es fällt nach und nach noch jede Menge Luminol aus.
Wilhelm Otto in Würzburg [5] hat sich 1961 eingehend mit den Synthesemöglichkeiten von Luminol beschäftigt und insbesondere auf die Nachvollziehbarkeit in
Schullaboratorien geachtet. Er hat die Synthese von Curtius und Semper aufgegriffen und weiterentwickelt. Der Vorteil bei dieser
Variante besteht darin, dass Hydrazin in einer Eintopfreaktion sowohl für die Herstellung des Hydrazides genutzt wird, als auch für die
Reduktion der Nitrogruppe.
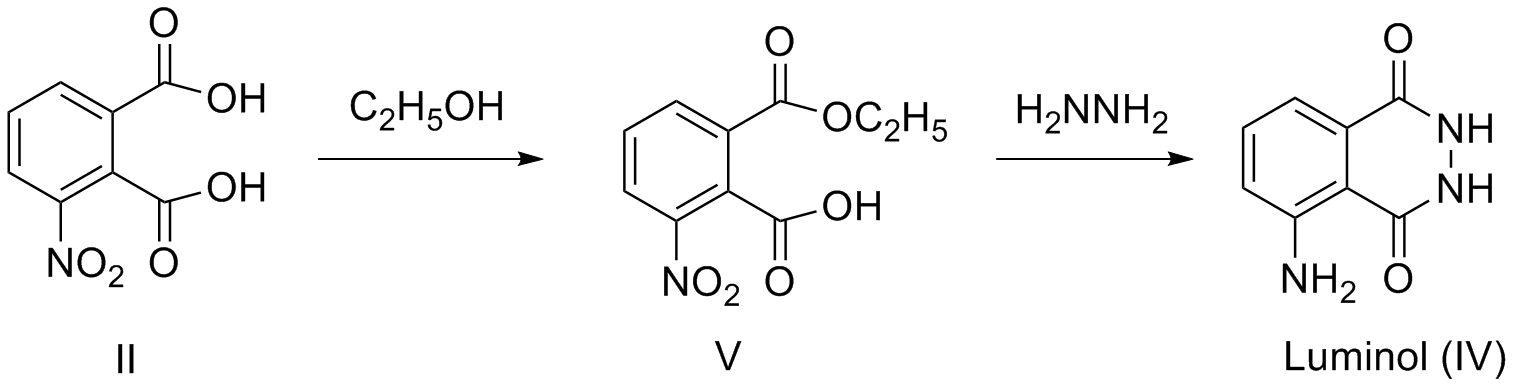
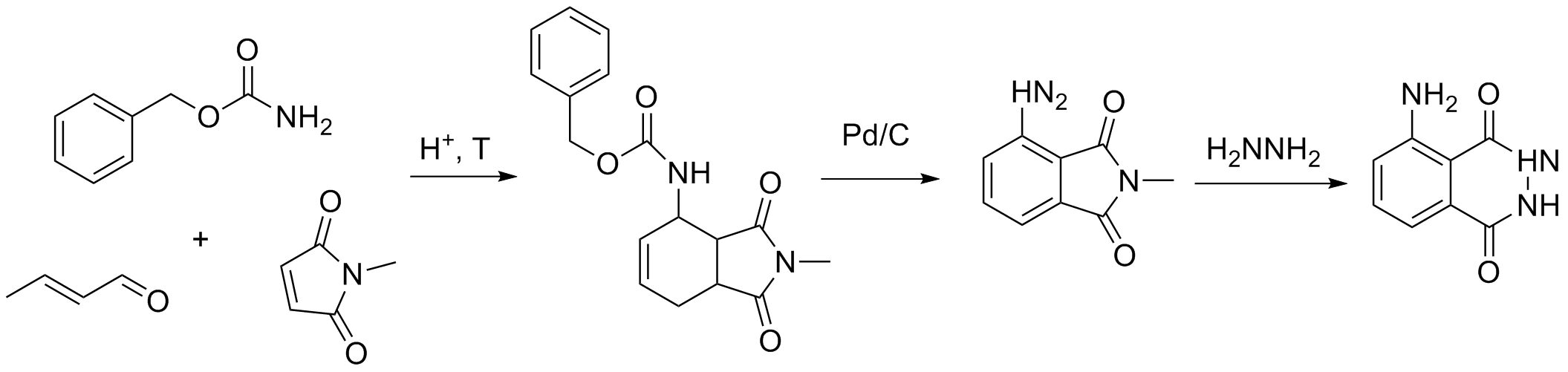
Als neues Zwischenprodukt tritt der Ester V auf der sich allerdings leicht herstellen lässt und der stabil und lagerfähig ist.
Auch diese Synthese habe ich selbst durchgeführt und kann sie im Wesentlichen bestätigen. Allerdings war meine Ausbeute deutlich niedriger als
angegeben, dafür ist das Verfahren sehr einfach.
Neuere Verfahren wurden vor Allem entwickelt um substituierte Luminole aufzubauen. Hierbei wird der aromatische Ring synthetisch direkt
aus einem geschützten Amin, einem ungesättigten Aldehyd und Maleinimid aufgebaut[8].
Eine super Synthese mit einfachen Ausgangsstoffen. Verwendet man einen substituierten Aldehyd so können andere Substituenden am Aromaten
eingeführt werden. Leider bin ich noch nicht dazu gekommen diese Variante selber zu probieren. Das währe vieleicht mal was für interessierte
Heimwerker.
Versuche zur Chemilumineszenz
Die Chemilumineszenz von Luminol wird durch Peroxide, im einfachsten Fall Wasserstoffperoxid, in alkalischer Lösung
ausgelöst. Diese Oxidationsreaktion erfolgt nur sehr langsam und das entstehende Licht ist mit bloßem Auge nicht zu sehen. Erst die
Verwendung von Katalysatoren beschleunigt die Reaktion, so dass genügend Photonen pro Zeiteinheit freigesetzt werden und man die
blaue Chemilumineszenz gut sehen kann. Die Quantenausbeute der Luminolreaktion beträgt um die 1,2 %, d. H von 100 umgesetzten Molekülen
strahlt lediglich eines ein Photon ab [9].
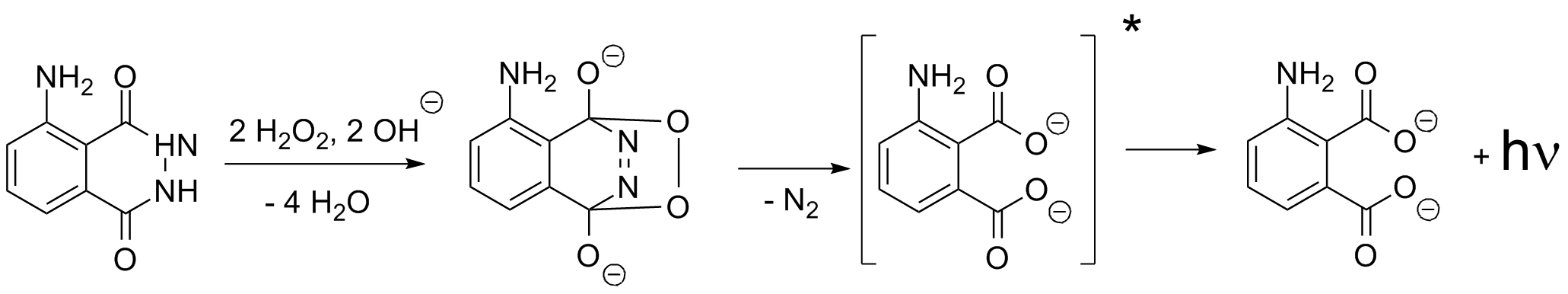
Katalysatoren sind z. B. Eisenkomplexe wie Hämin oder Blutlaugensalz. Sie wirken schon
in sehr geringen Konzentrationen und man erhält ein schönes gleichmässiges blaues Licht das einige Minuten anhält. Hierauf beruht z. B. der
Nachweis von Blutspuren in der Kriminalistik. Das in Blut enthaltene Hämin katalysiert die Chemilumineszenz von Luminol, welche man,
im Gegensatz zu den Blutspuren selbst, leicht sehen kann(Versuch 1)[6]. Luminol ist auch eine wichtige Chemikalie in der biochemischen und medizinischen Analytik.
Es wird dabei in zweierlei Weise verwendet. Es dient z. B. zum direkten Nachweis von reaktiven Sauerstoffderivaten ROS in Zellen und Geweben.
Zu den ROS zählen z. B. Wasserstoffperoxid, Peroxidradikalanionen, Singulett Sauerstoff und Hydroxidradikale. Da alle diese Moleküle
mit Luminol eine Chemilumineszenzreaktion geben, lässt sich die Konzentration dieser hoch reaktiven Verbindungen über deren Lichtemission bestimmen.
Eine weiteres Anwendungsgebiet sind Analysen die auf Immunoassays basieren. Hierbei wird ein Antikörper mit einem Enzym, z. B. der
Meerrettichperoxidase (HPP), markiert. Dieses Enzym ist ein ausgezeichneter Katalysator für die Chemilumineszenz von Luminol mit Wasserstoffperoxid.
Selbst aus dem wilden Stoffgemisch einer biologisch/medizinischen Probe reagiert der Antikörper nur mit seinem speziellen Antigen
und markiert es dadurch mit der Meerrettichperoxidase (HRP). Man braucht dann nur noch Wasserstoffperoxid und Luminol zuzusetzen und erhält
Chemilumineszenzlicht wobei die Lichtmenge proportional zur Stoffmenge an Antikörper und damit auch proportional zur Stoffmenge an Antigen ist.
[7] (Versuch 2). Ein besonders guter Katalysator für die Luminol Chemilumineszenz ist das Hypochlorit-Anion. Das abgestrahlte Licht
ist außerordentlich hell, hält dafür aber auch nur kurz an. Dadurch lassen sich wunderschöne Leuchteffekte erzielen, wie z. B. Chemilumineszenz-Leuchtsterne
(Versuch 3). Hypochlorit ist auch Bestandteil von Haushaltschemikalien und deshalb kann man Versuche wie das leuchtende Klo (Versuch 4)
auch gut zu Hause machen. Eine interesante Alternative ist die Anregung der Luminol Chemilumineszenz mit Ultraschall [10]. offenbar
reicht die Energie in einer Kavitationsblase aus um die CL anzuregen.
Hinweis zu Oxidationsmitteln: Normalerweise wird die Chemilumineszenz von Luminol in einer alkalischen Wasserstoffperoxid
Lösung durchgeführt. Das ist mitunter unpraktisch, vor allem wenn man Schauexperimente und Vorlesungsversuche in grösserem Maßstab durchführen will.
Auch wenn man mit Schülern oder anderen Nichtchemikern arbeitet und sie selbst experimentieren lassen möchte, sollte man auf Wasserstoffperoxid verzichten.
Eine echte Alternative bilden hier handelsübliche, feste Peroxidmischungen. Diese findet man unter der Bezeichnung "Oxidationsmittel auf
Sauerstoffbasis" in Vollwaschmitteln und vor allem in Gardinenbleichmitteln. Für meine Versuche verwende ich normalerweise "Sunil®" oder
"Beckmanns Gardinenweiß®". Beide Substanzen enthalten Percarbonat als Peroxidquelle und reagieren in wässriger Lösung alkalisch.
Es bedarf daher auch keiner zusätzlichen Laugenzugabe.
1: Luminol Stammlösung mit Sunil®: 12 g Sunil werden in 100 ml Wasser bei Raumtemperatur gerührt. Es entsteht eine milchig trübe Suspension.
Zu dieser Suspension gibt man 300 mg Luminol (1,7 mmol) und rührt weitere 10 min. Je nach Qualität des eingesetzten Luminols erhält
man eine milchig weiße bis milchkaffeefarbene Suspension. Sie ist über mindestens 12 h lagerstabil und kann für die meisten Demonstrationsversuche
verwendet werden.
2. Luminol Pulvermischung mit Beckmanns Gardinenweiß®: Hierfür werden 10 g Gardinenweiß mit 500mg Luminol
gut gemischt. Das dabei erhaltene Pulver ist bei trockener Lagerung monatelang haltbar. Gardinenweiß enthält neben 30 % Percarbonat
auch noch hoch reichlich
Optischen Aufheller. Dieser scheint die Luminol Chemilumineszenz als Sensibilisator zu verstärken.
Mischungen aus Luminol und einem peroxidhaltigen Waschmittel nennen wir LumiInstant.

Hämin als Katalysator für die Luminol Chemilumineszenz ist ein echter Klassiker. In diesem Versuch
geht es darum die untere Nachweisgrenze für Hämin in etwa abzuschätzen. Dazu stellt man eine Verdünnungsreihe her. Ich habe 12 mg Hämin
(0,018 mmol)zusammen mit einer Spatelspitze Natriumcarbonat in 10 ml Wasser gelöst. Jeweils 1 ml der Luminol/Sunil Stammlösung
wurde in ein Reagenzglas gegeben und mit 5 ml Wasser aufgefüllt. Dazu wurden wurden 0.05 ml, 0.1 ml, 0,2 ml, 0.4 ml, 0.8 ml und 1,6 ml
der Häminlösung gegeben und der Raum verdunkelt. Selbst bei 0,05 ml Häminlösung, das enspricht 0,06 mg Hämin ist ein deutliches blaues
Leuchten zu beobachten.
Eine Spatelspitze LumiInstant wurde in ca 2 ml Wasser gelöst und über eine abgeschnittene Scheibe
einer Meerrettichwurzel gegossen. In einem dunklen Raum kann man sofort eine sehr helle Chemilumineszenz beobachten. Dies ist ein schönes Experiment für abendliche
Partys. Viele Gemüse enthalten Peroxidasen und sind in der Lage die Luminol Chemilumineszenz zu katalysieren (z. B. Kohlrabi und Radieschen),
man muss es nur mal ausprobieren.

Da DanKlorix und Gardinenweiß typische Haushaltschemikalien sind, kann man Versuche damit auch zu Hause machen.
Als Labor dient das Bad und als Reaktionsgefäß das WC. Zunächst gibt man etwas DanKlorix in das Klobecken. Dann löscht man das Licht gibt eine
Luminol/Sunil oder Luminol/Gardinenweiß Lösung dazu. Man wird mit einem schönenen Leuchtenden WC Becken belohnt. Ein Video dazu gibt es bei youtube
unter dem Suchwort
Leuchtendes Klo.

Man nimmt ein Stück weißen Stoff, z. B. von einem Bettlaken und tränkt dieses mit Wasser dem man etwas
Reinigungsmittel mit Hypochlorit (z. B. DanKlorix®) zugesetzt hat. Das Tuch lässt man etwas abtropfen und hängt es schön breit auf.
Dann füllt man die Luminol/Sunil Lösung in eine Sprühflasche, löscht das Licht und besprüht das Tuch mit der Luminollösung.
Jeder Tropfen der auf das Tuch trifft, erzeugt einen blauen Lichtblitz. Es entsteht ein wahrer
Luminol-Sternenregen.
3. Luminol im aprotischen Medium: Luminol lässt sich nicht nur mit Wasserstoffperoxid zum Leuchten anregen. Unter stark
alkalischen Bedingungen reagiert Luminol auch mit dem Sauerstoff der Luft. Dies erfordert allerdings einen Wechsel des Löungsmittels.
Dimethylsulfoxid erweist sich als geeignet, weil es sowohl Kaliumhydroxid (die Base) als auch Luminol löst. Der Versuchsaufbau ist denkbar einfach.
Man bedeckt den Boden eines Erlenmeyerkolbens mit Kaliumhydroxid - Plätzchen und gibt 2-3 ml DMSO zu, gefolgt von einer Spatelspitze Luminol.
Wird das Ganze gut durchgeschüttelt, so zeigt sich eine ziemlich helle Chemilumineszenz. Im Gegensatz zur Reaktion in Wasser ist hier die Emission eher
blaugrün. Das Leuchten verschwindet wenn man den Erlenmeyer verschließt, weil dann der Sauerstoff aufgebraucht wird. Öffnen und
schütteln startet die Reaktion erneut.
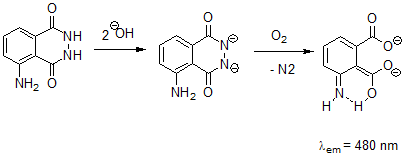
Der Mechanismus ist so publiziert, aber ob er wirklich stimmt, muss sich erst noch herausstellen. Wie immer ist das Problem der Sauerstoff,
der von Diradikal zum Dianion gebracht werden muss. Zählt man die beteiligten Elektronen, gibt es in der Bilanz einen Elektronenüberschuss der irgendwo untergebracht werden muss, aber wo?

Das Bild zeigt die Chemilumineszenz von Luminol im System KOH/DMSO. Diese ist ein schönes Beispiel für eine sauerstoffabhängige
Reaktion. Das Leuchten hält längere Zeit an wobei das Verlöschen durch Sauerstoffmangel und das Wideraufleuchten mehrmals durchgeführt werden können.
Fazit: Auch über 100 Jahre nach seiner Entdeckung ist Luminol immer noch eine interessante Substanz, die für vielerlei Zwecke Einsetzbar ist.
Selbst die Synthese bietet noch Potential für Verbesserungen. Mit unseren heutigen Kenntnissen und Möglichkeiten lassen
sich noch viele schöne Experimente durchführen. Man braucht nur ein bisschen Phantasie.
Literatur
- A. J. Schmitz, Diss. Heidelberg 1902
- Th. Curtius, A. Semper, Chem. Ber. 46 (1913) 1165-1170
- H. O. Albrecht, Z. phys. Chem. 136 (1928)321
- K. Gleu, K. Pfannstiel, J. prakt. Chem. 146 (1936) 137-150; R. Wegler, J. prakt Chem., 148 (1937) 135-160
- W. Otto in Würzburg, Praxis der Naturwissenschaften, 10 (1961) 19-12 und 33-37
- H. Brandl, Praxis der Naturwissenschaften Chemie, 5/53 (2004) 27-31
- S. Albrecht, H. Brandl, Th. Zimmermann, Chemilumineszenz, Hüthig Verlag Heidelberg, 1996
- R. Pérez-Ruiz, R. Fichtler Y. Diaz-Miara, M. Nicoul, D. Schaniel,H. Neumann, M. Beller, D. Blunk, A. G. Griesbeck,
A. Jacobi von Wangelin; On the Photophysical Properties of New Luminol Derivatives and their Synthetic Phthalimide Precursors;
J. Fluoresc. 20 (2010) 657-664
- H. Brandl, D. Weiß, S. Albrecht; MNU (Der mathematische und naturwissenschaftliche Unterricht), 64/3 (2011) 160 - 165
- Y. Ando, K. Niwa, N. Yamada, T. Irie, T. Enomoto, H. Kubota, Y. Ohmiya, H. Akiyama; Determination
and spectroscopy of quantum yields
- D. F. Rivasa, M. Ashokkumarb, Th. Leongb, K. Yasuid, T. Tuziutid, S. Kentishb, D. Lohsec, H. J.G.E. Gardeniersa;
Ultrasonics Sonochemistry, 19(6)(2012)1252- 1259
- W. J. Baader, C. V. Stevani, E. L. Bastos, The chemistry of peroxides, volume 2
Edited by Z. Rappoport, 2006 John Wiley & Sons, Ltd. S. 1212 - 1270




 Hämin als Katalysator für die Luminol Chemilumineszenz ist ein echter Klassiker. In diesem Versuch
geht es darum die untere Nachweisgrenze für Hämin in etwa abzuschätzen. Dazu stellt man eine Verdünnungsreihe her. Ich habe 12 mg Hämin
(0,018 mmol)zusammen mit einer Spatelspitze Natriumcarbonat in 10 ml Wasser gelöst. Jeweils 1 ml der Luminol/Sunil Stammlösung
wurde in ein Reagenzglas gegeben und mit 5 ml Wasser aufgefüllt. Dazu wurden wurden 0.05 ml, 0.1 ml, 0,2 ml, 0.4 ml, 0.8 ml und 1,6 ml
der Häminlösung gegeben und der Raum verdunkelt. Selbst bei 0,05 ml Häminlösung, das enspricht 0,06 mg Hämin ist ein deutliches blaues
Leuchten zu beobachten.
Hämin als Katalysator für die Luminol Chemilumineszenz ist ein echter Klassiker. In diesem Versuch
geht es darum die untere Nachweisgrenze für Hämin in etwa abzuschätzen. Dazu stellt man eine Verdünnungsreihe her. Ich habe 12 mg Hämin
(0,018 mmol)zusammen mit einer Spatelspitze Natriumcarbonat in 10 ml Wasser gelöst. Jeweils 1 ml der Luminol/Sunil Stammlösung
wurde in ein Reagenzglas gegeben und mit 5 ml Wasser aufgefüllt. Dazu wurden wurden 0.05 ml, 0.1 ml, 0,2 ml, 0.4 ml, 0.8 ml und 1,6 ml
der Häminlösung gegeben und der Raum verdunkelt. Selbst bei 0,05 ml Häminlösung, das enspricht 0,06 mg Hämin ist ein deutliches blaues
Leuchten zu beobachten.
 Eine Spatelspitze LumiInstant wurde in ca 2 ml Wasser gelöst und über eine abgeschnittene Scheibe
einer Meerrettichwurzel gegossen. In einem dunklen Raum kann man sofort eine sehr helle Chemilumineszenz beobachten. Dies ist ein schönes Experiment für abendliche
Partys. Viele Gemüse enthalten Peroxidasen und sind in der Lage die Luminol Chemilumineszenz zu katalysieren (z. B. Kohlrabi und Radieschen),
man muss es nur mal ausprobieren.
Eine Spatelspitze LumiInstant wurde in ca 2 ml Wasser gelöst und über eine abgeschnittene Scheibe
einer Meerrettichwurzel gegossen. In einem dunklen Raum kann man sofort eine sehr helle Chemilumineszenz beobachten. Dies ist ein schönes Experiment für abendliche
Partys. Viele Gemüse enthalten Peroxidasen und sind in der Lage die Luminol Chemilumineszenz zu katalysieren (z. B. Kohlrabi und Radieschen),
man muss es nur mal ausprobieren.
 Da DanKlorix und Gardinenweiß typische Haushaltschemikalien sind, kann man Versuche damit auch zu Hause machen.
Als Labor dient das Bad und als Reaktionsgefäß das WC. Zunächst gibt man etwas DanKlorix in das Klobecken. Dann löscht man das Licht gibt eine
Luminol/Sunil oder Luminol/Gardinenweiß Lösung dazu. Man wird mit einem schönenen Leuchtenden WC Becken belohnt. Ein Video dazu gibt es bei youtube
unter dem Suchwort Leuchtendes Klo.
Da DanKlorix und Gardinenweiß typische Haushaltschemikalien sind, kann man Versuche damit auch zu Hause machen.
Als Labor dient das Bad und als Reaktionsgefäß das WC. Zunächst gibt man etwas DanKlorix in das Klobecken. Dann löscht man das Licht gibt eine
Luminol/Sunil oder Luminol/Gardinenweiß Lösung dazu. Man wird mit einem schönenen Leuchtenden WC Becken belohnt. Ein Video dazu gibt es bei youtube
unter dem Suchwort Leuchtendes Klo.
 Man nimmt ein Stück weißen Stoff, z. B. von einem Bettlaken und tränkt dieses mit Wasser dem man etwas
Reinigungsmittel mit Hypochlorit (z. B. DanKlorix®) zugesetzt hat. Das Tuch lässt man etwas abtropfen und hängt es schön breit auf.
Dann füllt man die Luminol/Sunil Lösung in eine Sprühflasche, löscht das Licht und besprüht das Tuch mit der Luminollösung.
Jeder Tropfen der auf das Tuch trifft, erzeugt einen blauen Lichtblitz. Es entsteht ein wahrer Luminol-Sternenregen.
Man nimmt ein Stück weißen Stoff, z. B. von einem Bettlaken und tränkt dieses mit Wasser dem man etwas
Reinigungsmittel mit Hypochlorit (z. B. DanKlorix®) zugesetzt hat. Das Tuch lässt man etwas abtropfen und hängt es schön breit auf.
Dann füllt man die Luminol/Sunil Lösung in eine Sprühflasche, löscht das Licht und besprüht das Tuch mit der Luminollösung.
Jeder Tropfen der auf das Tuch trifft, erzeugt einen blauen Lichtblitz. Es entsteht ein wahrer Luminol-Sternenregen.
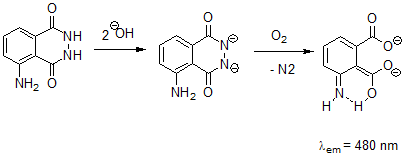 Der Mechanismus ist so publiziert, aber ob er wirklich stimmt, muss sich erst noch herausstellen. Wie immer ist das Problem der Sauerstoff,
der von Diradikal zum Dianion gebracht werden muss. Zählt man die beteiligten Elektronen, gibt es in der Bilanz einen Elektronenüberschuss der irgendwo untergebracht werden muss, aber wo?
Der Mechanismus ist so publiziert, aber ob er wirklich stimmt, muss sich erst noch herausstellen. Wie immer ist das Problem der Sauerstoff,
der von Diradikal zum Dianion gebracht werden muss. Zählt man die beteiligten Elektronen, gibt es in der Bilanz einen Elektronenüberschuss der irgendwo untergebracht werden muss, aber wo?
 Das Bild zeigt die Chemilumineszenz von Luminol im System KOH/DMSO. Diese ist ein schönes Beispiel für eine sauerstoffabhängige
Reaktion. Das Leuchten hält längere Zeit an wobei das Verlöschen durch Sauerstoffmangel und das Wideraufleuchten mehrmals durchgeführt werden können.
Das Bild zeigt die Chemilumineszenz von Luminol im System KOH/DMSO. Diese ist ein schönes Beispiel für eine sauerstoffabhängige
Reaktion. Das Leuchten hält längere Zeit an wobei das Verlöschen durch Sauerstoffmangel und das Wideraufleuchten mehrmals durchgeführt werden können.