

Auch Chemilumineszenz gehorcht zunächst einmal den allgemeinen Gesetzen der Lumineszenz, d. h. ein Elektron wird durch Energiezufuhr in ein energetisch höher liegendes Orbital befördert und gibt die Energie als Photon ab, wenn es in sein ursprüngliches Orbital zurückkehrt. Was bei der Fluoreszenz recht einfach ist, weil die Absorption von Photonen klaren Gesetzten und Regeln gehorcht, erweist sich bei der Chemilumineszenz als ein ausgesprochen komplexes Problem. Hier muss die nötige Energie durch eine vorgelagerte chemische Reaktion aufgebracht werden. Soll z. B. Licht mit einer Wellenlänge von 500nm emittiert werden, so kann man mit der Einstein- Formel E = m x c2 die dafür benötigte Energie ausrechnen. Das sind gerade mal 228 kJ/mol, sollte also machbar sein. Warum gibt es denn denn so wenig Chemilumineszenz-Reaktionen? Es gibt weitere Randbedingungen. Bereits Chandross und Sonntag [1] postulierten 1964 dass die Reaktionsenthalpie in einem einzigen Reaktionsschritt, in möglichst kurzer Zeit und in möglichst kleinem Volumen freigesetzt werden sollte. Aber auch das ist noch kein Garant für eine effektive Chemilumineszenzreaktion.
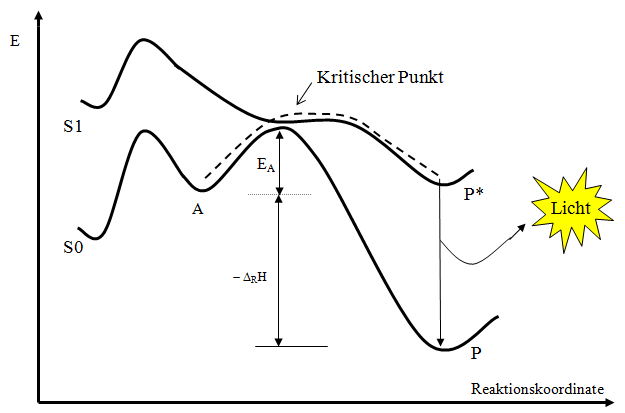
Das Reaktionsablaufschema zeigt, wie man sich eine Chemilumineszenzreaktion vorstellt (A=Ausgangsstoff, P=Produkt, E=Energie, EA=Aktivierungsenergie)
Das Problem ist, dass sich an einem Punkt der Reaktion die Energiehyperfläche des Grundzustandes S0 und die Energiehyperfläche des Angeregten Zustandes S1 so nahe kommen müssen, dass ein Übergang in den Angeregten Zustand erfolgen kann [2]. Das obige Diagramm zeigt einen Schnitt durch beide Energiehyperflächen in Richtung der Reaktionskoordinate, um das Problem zu verdeutlichen. Eine mathematische Beschreibung des Überganges liefert die Markus - Theorie. Im Prinzip ist immer ein Übergang möglich, auch wenn die Wahrscheinlichkeit dafür mit zunehmenden Abstand der Hyperflächen immer kleiner wird. Oft genügen daher schon kleine Änderungen am Molekül um eine vorher starke Emission stark abzuschwächen oder gar zu verhindern. Deshalb werden auch solche 100 Jahre alten Verbindungen wie Luminol oder Lucigenin heute noch verwendet. Sie stellen schon das Optimum ihrer Verbindungsklasse dar und alle Versuche höhere Quantenausbeuten zu erzielen sind gescheitert oder im Sande verlaufen. Dank hoch empfindlicher Messmethoden lassen sich heute auch einzelne Photonen nachweisen. Wenn nur noch so wenig Licht emmitiert wird, dass man es auch mit einem gut dunkel adaptierten Auge nicht mehr sehen kann, dann spricht man von Ultraschwacher Lumineszenz. Mit einem geeignetem Messgerät (Luminometer), kann man solche Emissionen leicht messen und nachweisen. Auch Lebewesen strahlen bei ihren normalen Lebensprozessen Licht ab. Die Forschungsrichtung dazu ist die Biophotonik. In der Chemie selbst sind ultraschwache Emissionen wenig erforscht, weil es trotz aller Einschränkungen genügend lichtstarke Chemilumineszenzsysteme gibt.
Chemilumineszenz kann bei vielen Oxidationsreaktionen beobachtet werden. Eine Gruppe von Sauerstoffverbindungen zeichnet sich aber durch besonders helle und intensive Lichtemissionen aus und das sind die cyclischen Peroxide. Auch bei besonders hellen Biolumineszenzreaktionen sind meist cyclische Peroxide im Spiel. Die Muttersubstanz ist das 1,2-Dioxetan, von dem sich durch Substitution der Wasserstoffatome die verschiedenen 1,2-Dioxetane und durch Oxidation die Dioxetanone und das Dioxetandion ableiten. Dioxetane sind metastabil, d. H. man kann sie herstellen aber sie zerfallen mehr oder weniger rasch wieder. Die Stabilität kann durch geeignete Substituenden so stark erhöht werden, dass man handelsfähige Substanzen bekommt (z. B. AMPPD). Dioxetanone sind noch weniger stabil aber sie treten als die entscheidenden Zwischenprodukte bei verschiedenen Biolumineszenz- und Chemilumineszenzreaktionen auf [3].
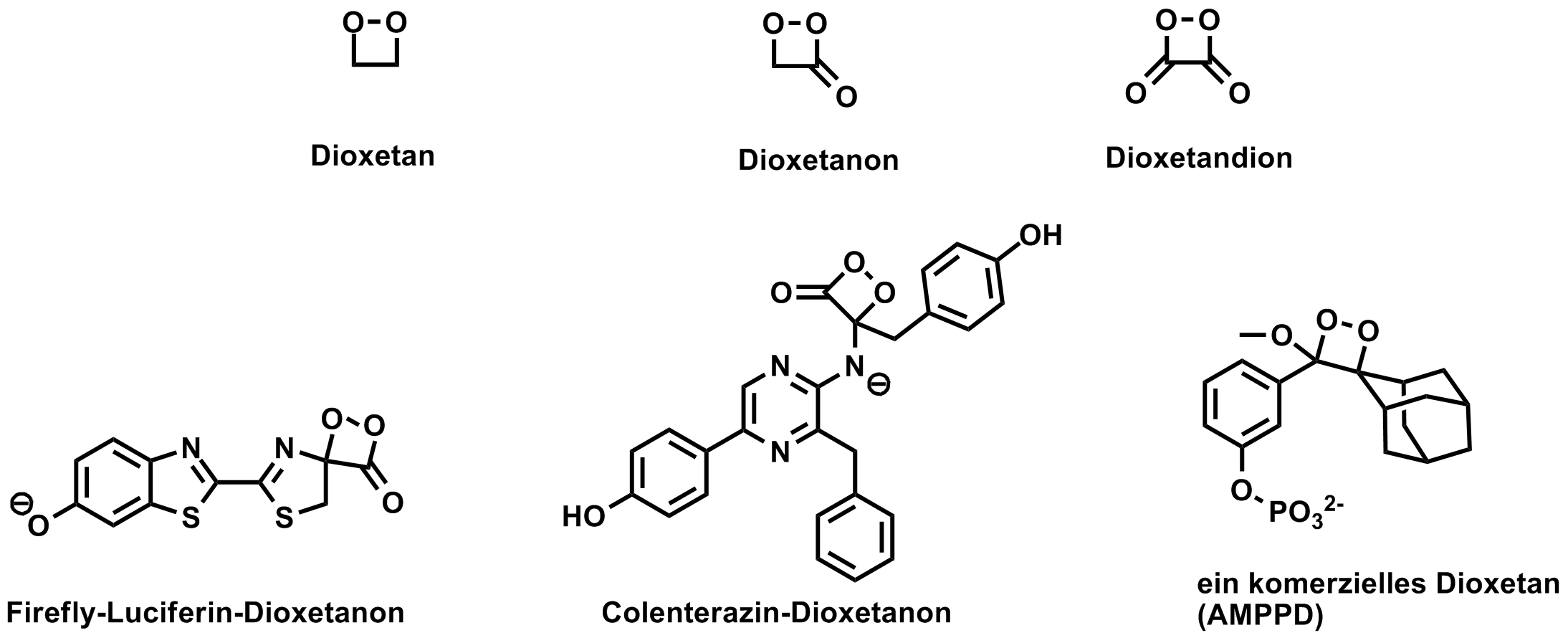
Der Nachweis solcher instabiler Zwischenprodukte ist nicht einfach, gelingt aber durch ausgefeilte kinetische Untersuchungen, Herstellung von Modellsubstanzen und NMR-Messungen.
Weißer Phosphor: Da sich Lichtemissionen auch ohne Meßgerät leicht beobachten lassen, verwundert es nicht, dass die erste literaturbekannte Chemilumineszenz schon 1669 von dem Hamburger Alchemisten Heinrich Hennig Brand durchgeführt wurde. Er destillierte Urin bis zur Trockne ein und erhitzte noch ein wenig und konnte dann einen schwachen gelbgrünen Schimmer des Kolbeninhaltes beobachten. Heute wissen wir, dass es sich dabei um die Chemilumineszenz handelt die durch Oxidation von weißem Phosphor hervorgerufen wird.
Oxidation von Lophin: Die erste Chemilumineszenz eines organischen Moleküls wurde 1877 von Radziewski beobachtet [4]. Er schreibt: "Es genügt einige Centigramme Lophin in einem Probirröhrchen mit concentrirter alkoholischer Kali- oder Natronlösung zu übergiessen, um eine Lichtentwickelung zu constatiren." Für die Herstellung von Lophin benötigt man nur Benzaldehyd und Ammoniak. Eine Vorschrift findet sich bei illumina. Aus Benzaldehyd und Ammoniak bildet sich zunächst Hydrobenzamid das dann durch Erhitzen in Amarin und bei noch höherer Temperatur in das Lophin übergeht.
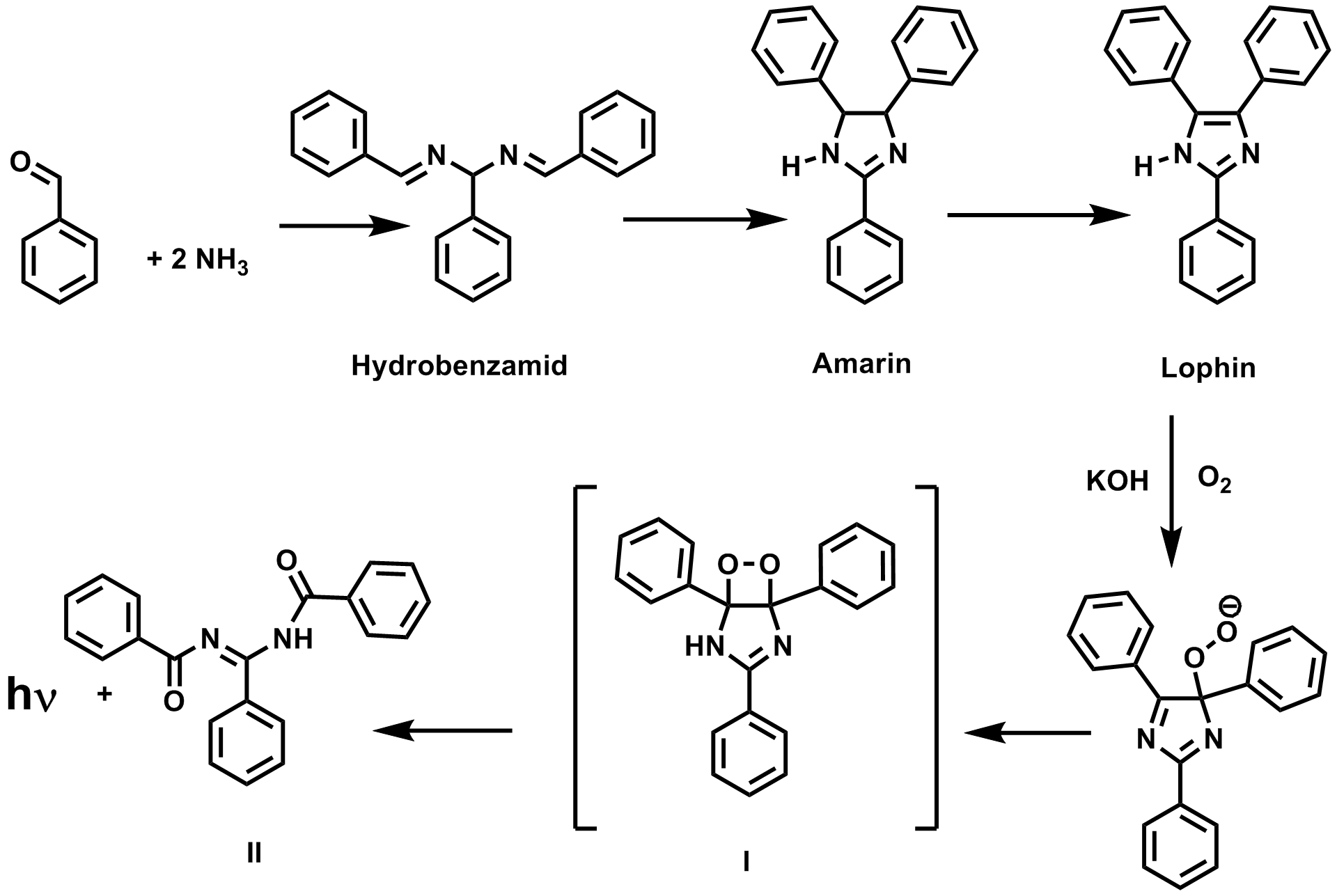
So stellt man sich die Bildung und die Oxidation von Lophin vor. Letztlich ist es eine etwas aufwändige Oxidation von Benzaldehyd zu Benzoesäure.
Lophin reagiert in alkalischer Lösung mit Luftsauerstoff was zur Chemilumineszenz führt. Das cycliche Peroxid I ist ein typisches Chemilumineszenz Zwischenprodukt wie es in vielen anderen Chemilumineszenzreaktionen auftritt. Dieses Produkt kann auch entstehen wenn man die Chemilumineszenzreaktion mit Wasserstoffperoxid durchführt und Hypochlorit zusetzt. Der dabei entstehende Singulett Sauerstoff reagiert direkt mit Lophin unter Bildung von I. Das Endprodukt ist Benzoesäure die durch Hydrolyse von II entsteht.
Radziewski schreibt zum Schluß: " Lophin und die damit verwandten Körper liefern uns ein lehrreiches Beispiel, dass durch gewisse in kleinem Maasstabe und sehr langsam vor sich gehende chemische Processe sehr starke Schwankungen des Weltäthers entstehen können, welche gewiss eine Wirkung auf das Nervensystem und resp. auf die von demselben abhängigen physiologischen und psychologischen Functionen ausüben müssen." Also immer schön vorsichtig sein!Trautz-Schorgin-Reaktion: Die Entdeckung der Chemilumineszenz von Lophin (1877, Radziewski) führte möglicherweise auch dazu, dass man bei anderen Umsetzungen mal genauer hingeschaut hat. Fündig geworden ist man recht schnell beim photographischen Prozess. Bei der Entwicklung von photographischen Platten und Gelen wurde anfangs noch viel herumexperimentiert. Dabei stellte man fest, dass Lösungen von Formaldehyd und aromatischen Phenolen bei Luftzufuhr anfangen schwach zu leuchten [5]. P. Schorgin verfasste 1905 die erste Dissertation [6] die sich direkt und ausschließlich mit Lumineszenz befasst u. a. auch mit der Oxidation von Formaldehyd in Gegenwart von Phenolen, der Trautz-Schorgin-Reaktion. Der Mechanismus dieser Reaktion ist sehr komplex. An Stelle von Formaldehyd kann man auch Glutardialdehyd, Methanol oder sogar Glycerin verwenden. Bei den letzten beiden startet die Reaktion aber erst, wenn man die Reaktionsmischung auf mindestens 70°C erhitzt. Als Phenolquelle kommen auch Tannin oder die Polyphenole aus schwarzem Tee in Frage [7].
Arbeitsvorschrift: Lösung 1 - 1g Pyrogallol in 10 ml Wasser, Lösung 2 - 5g Kaliumcarbonat in 10 ml Wasser, Lösung 3 - 10 ml Formaldehyd 35%, Lösung 4 - 15 ml Wasserstoffperoxid 30%. In einem abgedunkelten Raum werden die Lösungen nacheinender in ein hohes Becherglas oder einen Erlenmeyer gegossen und kurz umgerührt. Die Reaktion ist stark exotherm und heizt sich schnell auf, wobei Schaum entsteht. Das ganze zeigt eine orangerote Chemilumineszenz.
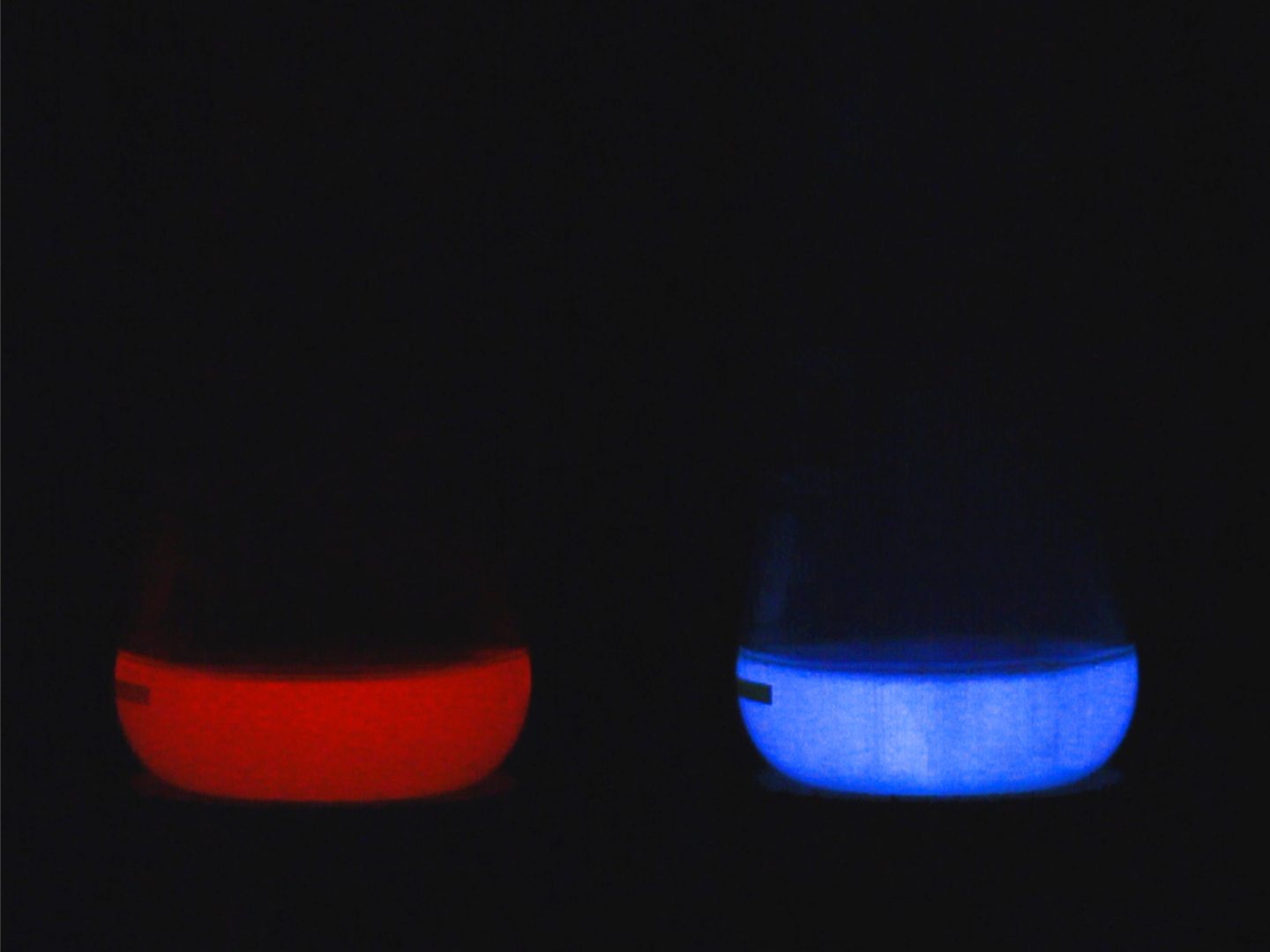
das Bild zeigt die typische Emission der Trautz-Schorgin-Reaktion (links). Bei Zugabe von Luminol schlägt die Emissionsfarbe bei höherer Temperatur nach blau um.
Hinweis: Vorsicht! die Lösung neigt zum Überkochen. Man kann die Starke Wärmeentwicklung ausnutzen um eine zweifarbige Emission zu erzeugen. Dies erreicht man durch Zugabe von etwas Luminol. Bei ca 80°C wird Luminol auch ohne Katalysator von Wasserstoffperoxid oxidiert und leuchtet blau. Man erzeugt so nacheinander eine rote und eine blaue Emission.
Bronislaus Raziszewski ist nicht nur der Entdecker der Lophin Chemilumineszenz, er hat auch andere, heute in Vergessenheit geratene, Chemilumineszenzreaktionen gefunden [8]. Viele Von diesen als sehr hell oder gut sichtbar beschriebenen Reaktionen ließen sich aber leider bei mir im Labor nicht navollziehen.
Luminol: Der wohl bekannteste zur Chemilumineszenz befähigte Stoff, das Luminol wurde bereits 1902 synthetisiert, die Chemilumineszenz allerdings erst 1928 beschrieben [9]. Zum Luminol gibt es eine eigene Seite, deshalb soll an dieser Stelle nicht weiter darauf eingegangen werden.
Lucigenin: Lucigenin wurde bereits 1936 erstmals hergestellt und beschrieben [10]. Die Herstellung erfolgt durch reduktive Dimerisierung von N-Methylacridon und anschließenden Austausch des Gegenions. Auch hier bietet Lambdasyn hervorragend beschriebene und bebilderte Synthesevorschriften.
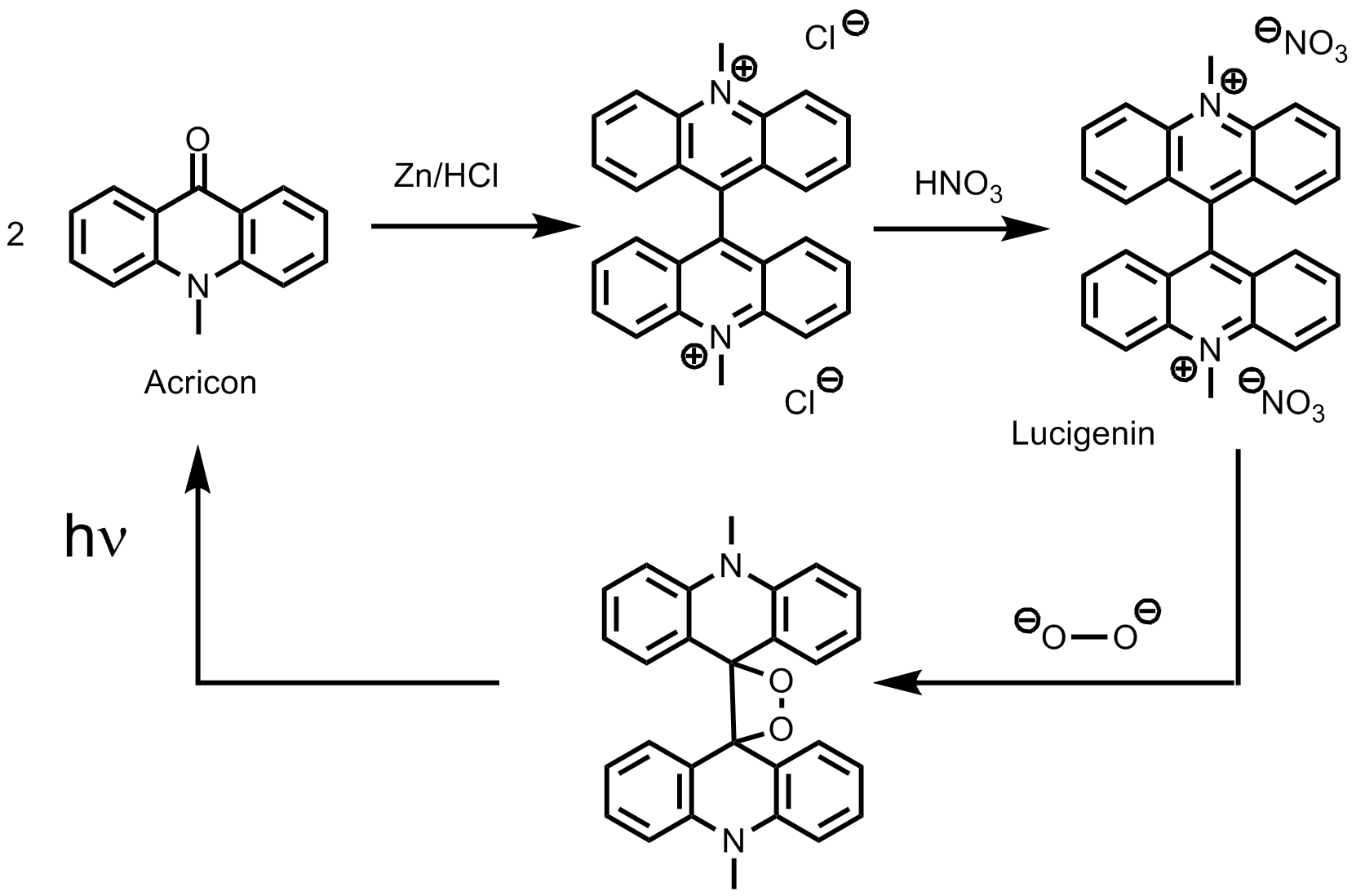
Lucigenin reagiert mit dem Dianion des Wasserstoffperoxids wobei ein Dioxetan gebildet wird. Das zerfällt unter Aussendung von Licht in zwei Moleküle Acridon. Der eigentliche Emitter ist das Acridon mit einer Emission bei 401 nm. Lucigenin selbst hat eine grüne Fluoreszenz. Zu beginn der Reaktion ist die Konzentration von Lucigenin noch hoch und das bei der CL-Reaktion entstehende angeregte Acridon überträgt seine Energie auf das noch nicht umgesetzte Lucigenin. Daher ist die Emissionsfarbe zu Begin der Reaktion noch grün. und ändert sich im Verlauf der Reaktion zu blau. Auf Gund seiner Löslichkeit und der relativ hohen Quantenausbeute eignet sich Lucigenin sehr gut zur Bestimmung von Wasserstoffperoxidkonzentrationen in Zellen und Geweben[11].
Peroxioxalat Chemilumineszenz: in den frühen 60iger Jahren bemerkte Chandross dass Oxalsäurechlorid mit Wasserstoffperoxid eine Chemilumineszenz gibt, wenn ein Fluoreszenzfarbstoff zugegen ist [12].

An Stelle des Säurechlorides werden heute Ester der Oxalsäure mit elektronenarmen Aromaten genommen. Bei eingesetzten Farbstoffen gibt es eine reichhaltige Auswahl, so dass praktisch alle Emissionsfarben möglich sind. Auch der Reaktionsmechanismus ist weitgehend aufgeklärt [13]. Auch für diese Chemilumineszenz gibt es eine eigene Seite.
1,2-Dioxetane Wie bereits im Abschnitt über cyclische Peroxide bereits erwähnt, sind 1,2-Dioxetane metastabile Verbindungen, d. H. sie zerfallen nach und Nach in einer Reaktion erster Ordnung in zwei Carbonylbruchstücke. Die thermische Stabilität wird dabei extrem von den Susbstituenden beeinflusst [14]. Das besondere daran ist, dass hier zwei Carbonylbruchstücke erzeugt werden wovon sich eines im Triplett Zustand befindet [14, 15]. Das Licht das dabei entsteht ist relativ schwach aber man kann duch eine CIEEL (chemically initiated electron exchange luminescence) Reaktion deutlich mehr Licht erhalten. Näheres hierzu auf der Dioxetane Webseite
Coumaranone Diese Verbindungsklasse zählt zu den jüngsten entdeckten chemilumineszenten Verbindungen. Erst 1979 konnten einige Vertreter hergestellt und die Chemilumineszenz beschrieben werden [16]. Da das erzeugte Licht relativ schwach war, wurde diese Stoffgruppe lange Zeit nicht mehr bearbeitet und erst 1996 wieder ausgegraben [17]. Aber auch hier hielten sich die Erfolge in Grenzen, so dass das System wieder in der Versenkung verschwunden ist. Wir haben aus reiner Neugier, weil wir mal die Chemilumineszenz sehen wollten, die Coumaranone nachsynthetisiert, die Herstellungsmethode verbessert und neue Derivate erhalten. In Bezug auf die Chemilumineszenz ist uns so ein entscheidener Durchbruch gelungen [18] und die Coumaranone zählen jetzt zu den hellsten Chemilumineszenz Verbindungen überhaupt [19].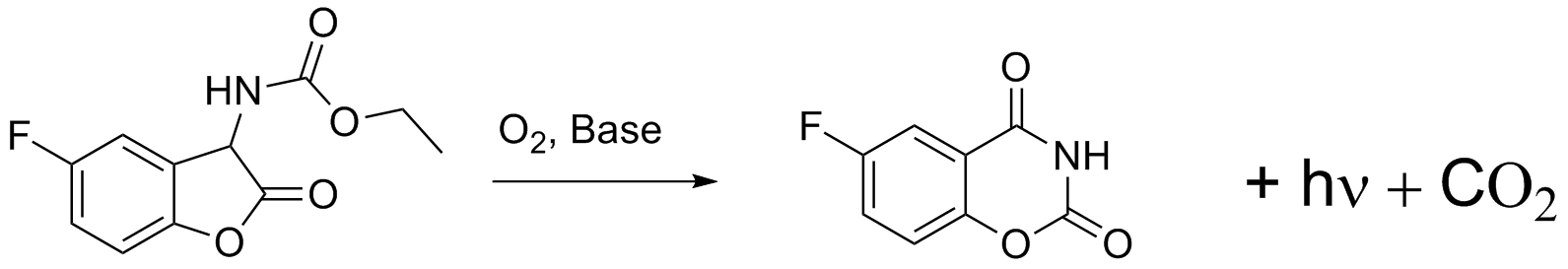

 Chemilumineszenz eines der ersten von uns hergestellten Coumaranons (links) und im Vergeich dazu das in der Reaktionsgleichung gezeigte Molekül (rechts)
Chemilumineszenz eines der ersten von uns hergestellten Coumaranons (links) und im Vergeich dazu das in der Reaktionsgleichung gezeigte Molekül (rechts)

 Wenn Chlorgas durch die Wasserstoffperoxidlösung blubbert, erzeugt jede Blase einen roten Lichtschein, die Emission von Singlett- Sauerstoff.
Video des Versuches
Wenn Chlorgas durch die Wasserstoffperoxidlösung blubbert, erzeugt jede Blase einen roten Lichtschein, die Emission von Singlett- Sauerstoff.
Video des Versuches