Farbstoffe sind in der Natur weit verbreitet. Im Gegensatz dazu gibt es
nur relativ wenige Fluoreszenzfarbstoffe. Dies mag daran liegen, dass die
einzige Quelle von UV - Licht in der Natur die Sonne darstellt. Bei hellem
Sonnenlicht ist die auftretende Fluoreszenz natürlich nicht zu sehen
und hat demzufolge keine direkte ökologische Bedeutung.
Ein eindrucksvolles Beispiel für einen natürlich vorkommenden
Fluoreszenzfarbstoff bildet das Aesculin aus der Roßkastanie. Man
braucht nur einen abgeschnittenen Kastanienzweig in ein Glas mit Wasser
stellen und mit einer UV-Lampe (366 nm) bestrahlen. Dabei kann man
beobachten, wie eine hellblau fluoreszierende Substanz aus dem Zweig
austritt und sich im Wasser löst. Im Querschnitt ist die farbstoffführende
Schicht gut zu sehen. Bei dieser blau fluoreszierenden Substanz handelt es
sich um ein 6,7-Dihydroxycumarinderivat ( Aesculin ). Dihydroxycumarine und deren Glycoside
kommen auch in anderen Pflanzen vor. In der Esche finden wir z. B. das Fraxin und im Seidelbast das Daphnin. Wie bei
der Kastanie können auch hier die Fluoreszenzfarbstoffe mit Wasser herausgelöst werden
. Die bereits 1929 von
beschriebene blaue Fluoreszenz von Cumarinen führte zur Entwicklung von optischen Aufhellern für
Textilfasern.
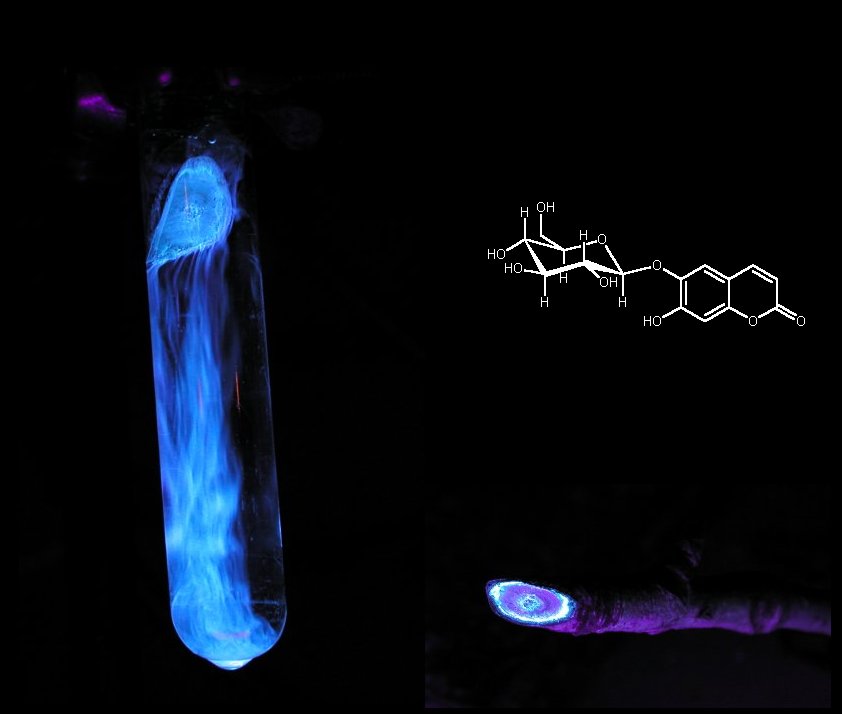
Die Abbildung zeigt einen Kastanienzweig der in Waser eintaucht und mit UV-Licht (366nm) bestrahlt wird.
Eine weitere fluoreszierende Stoffklasse bilden die Protoberberin -
Alkaloide mit dem dem Berberin als bekanntesten Vertreter. Protoberberin -
Alkaloide gehören zu den am weitesten verbreiteten Isochinolin -
Alkaloid - Typen. Sie kommen in Berberis- und Mahonia- Arten vor z. B.
auch in der Berberitze. Eine leicht zugängliche Quelle ist auch das überall
an Wegrändern und in Gärten und Parkanlagen vorkommende Schöllkraut
mit seinem durch Berberin gelb/orange gefärbten Milchsaft. Mit
Berberin lassen sich Seide, Baumwolle und Leder färben. Gibt man
einen Tropfen Schöllkraut Milchsaft auf die Haut und betrachtet diese
Stelle unter UV - Licht so kann man eine intensive gelbe Fluoreszenz
beobachten 2. Berberin ist giftig und wurde pharmakologisch intensiv
bearbeitet. Es wird zur Behandlung von Magenkrankheiten, Cholera und
Durchfall eingesetzt. Einige Protoberberin Alkaloide wirken bakterizid,
analgetisch, gebärmutterkontrahierend, hypnotisch oder auch sedativ.

Angeschnittene Schöllkrautwurzel mit austretenden Milchsaft (oben); Der Saft kann auf einem Holzstäbchen gesammelt
werden (ul). Ein Dünnschichtchromatogramm trennt die verschiedenen, fluoreszierenden Alkaloide auf (Ethanol/Wasser = 4/1).
Die wohl älteste beobachtete Fluoreszenzerscheinung geht ebenfalls von einem Holz aus. Ein spezielles Holz, "lignum nephriticum",
wurde bereits im Mittelalter als Arzneistoff gegen Nierenkrankheiten genutzt und gehandelt. Es gab ein einfaches Verfahren um
die Echtheit des Holzes zu prüfen. Man musste dazu nur ein paar Holzspäne in Wasser geben. War das Holz echt, so konnte man am Tageslicht
eine bläuliche Leuchterscheinung beobachten. Das heißt aus dem Holz wird ein Stoff herausgelöst der in Wasser eine so starke
Fluoreszenz zeigt, dass man sie selbst bei Tageslicht mit bloßem Auge sehen kann. Lignum nephriticum ist der Name des pharmazeutischen
Produktes aber es ist heute nicht mehr eindeutig, von welcher Pflanze das Holz gewonnen wurde. Es gibt zwei Kandidaten:
Eisenhardtia polystachia
aus Mittelamerika und
Pterocarpus indicus von den Philipinen. Beide Hölzer werden in der Volksmedizin gegen Nierenleiden
verwendet und beide zeigen die erwähnte Fluoreszenz. Im Holz selbst konnte aber nie ein Fluoreszenzfarbstoff gefunden werden.
Es hat über 500 Jahre gedauert um dieses Problem zu lösen. Im Holz selbst ist nur eine Vorstufe enthalten, aus der bei Kontakt mit Waser
und Luftsauerstoff über acht(!!) Reaktionsstufen Matlalin als der eigentliche Fluoreszenzfarbstoff gebildet wird
2,3.

Das Bild zeigt einige Späne von Narra Holz (Pterocarpus indicus), versetzt mit Wasser. Schon bei tageslicht (links)
ist die Fluoreszenz zu sehen. Die Fluoreszenz ist pH Wert abhängig und nur im schwach basischen Bereich gut zu erkennen. Die
Formel zeigt das Matlalin.
Interessanterweise sind Entdeckungen auf dem Gebiet der Fluoreszenz von Naturstoffen auch heute noch möglich. So überraschte
die Angewandte Chemie 2008 mit einem Beitrag über die Fluoreszenz von Bananen 4. Das ist von jedermann leicht zu beobachten,
der über eine Schwarzlichtlampe (366nm) verfügt. Es lohnt sich auch eine Bananenschale ein oder zwei Tage liegen zu lassen
und immer mal mit der UV - Lampe zu bestrahlen. Besonders die Innenschale zeigt mitunter an verschiedenen Stellen eine
schöne blaue Fluoreszenz. Ganz anders und viel intensiver ist die Fluoreszenz die als Ring rings um die kleinen braunen
Flecken, die sich bei zuhnehmender Reifung bilden, beobachten lässt. In In beiden Fällen handelt es sich wahrscheinlich
um die Fluoreszenz eines Abbauproduktes von Chlorophyll 5. Deshalb ist es auch nur bei einem bestimmten Reifegrad sichtbar.
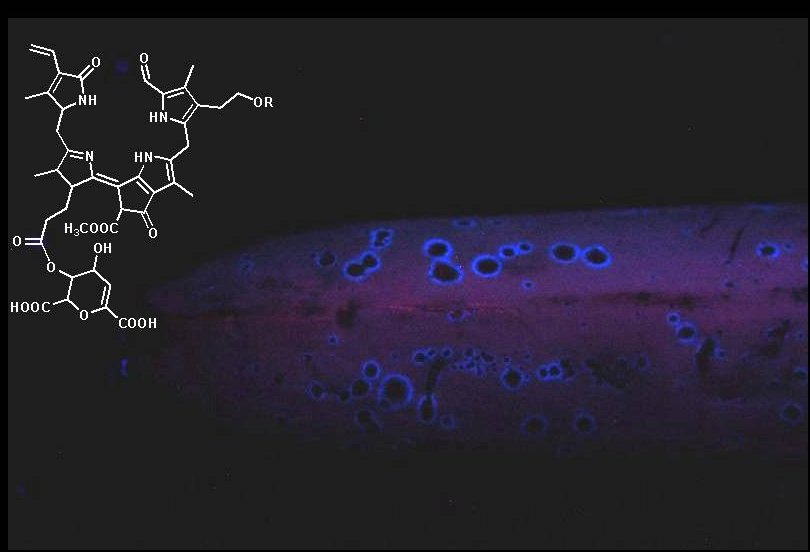
Das Bild einer Banane mit UV-Licht bestrahlt.
Es gibt noch weitere Abbauprodukte von Porphyringerüsten die sich in alltäglichen Produkten verstecken. Wie wäre es denn
mal mit braunen Hühnereiern. Unter der UV-Lampe betrachtet sieht man erst einmal nichts. Wenn man aber ein paar Tropfen Säure
auf die Eierschale tropft, werden die Ooporphyrine aus dem Kalkgerüst freigesetzt und zeigen eine schöne, rote Fluoreszenz. Besser macht
man den Versuch in einem Reagenzglas indem man einige Stücke zerkrümelter Eierschale hineingibt, mit verdünnter Salzsäure
übergießt und mit Essigester überschichtet. Der Essigester nimmt die Ooporphyrine auf und zeigt deren schöne rote Fluoreszenz.
Solche Ooporpyrine kommen auch in den Federn mancher Vogelarten (z. B. Trappenvögel), vor Allem an den nicht von der Sonne beschienen
Federkielen vor 6.

Das Bild zeigt einen Reagenzglasversuch mit braunen Eierschalen, wenig Salzsäure und Essigester, rechts unter UV-Bestrahlung.

Das Ganze geht auch direkt mit einem Hühnerei (links) auf das man einige Tropfen Essigessenz gibt (mitte), unter UV-Bestrahlung
kann man die Fluoreszenz sehen (rechts), ein schöner Versuch für zu Hause.
Wo wir schon mal bei Lebensmitteln sind, gibt es einen Lebensmittelfarbstoff der fluoresziert. Der Farbstoff E 101 (Riboflavin)
kommt natürlicherweise in Milch, Eiern und verschiedenen Gemüsesorten sowie Pilzen vor. Riboflavin ist nicht nur ein Farbstoff
sondern gehört auch zur Gruppe der B-Vitamine. Der Stoff kann günstig durch Mikroorganismen produziert und isoliert werden. Die gelbgrüne Farbe verleiht
den durch Herkunft oder Verarbeitung eigentlich blassen Lebensmitteln einen schönen, natürlichen Farbton.

Hier leuchten einige süß-sauer eingelegte Gurkenscheiben. Von Haus aus sehen sie eher blass aus aber mit Riboflavin richtig appetitlich.

Die Fluoreszenz von Chlorophyll in lebenden Organismen zu beobachten ist nicht einfach da die Anregungsenergie fast vollständig
über das Photosystem verbraucht wird. Aber man kann versuchen eine Gelbflechte (Xanthoria parietina) "pimpen". Lagert man sie schön feucht und hell
aber nicht sonnig, so fängt sie an ihre eingelagerten Algen zu vermehren und an die Oberfläche zu schieben. Dann kann man bei Bestrahlung mit
einer UV-Lampe auch die rote Fluoreszenz von Chlorophyll sehen.

Die Gelbflechte (Xanthoria parietina) bietet aber auch noch einen anderen Fluoreszenzfarbstoff, das Parietin. Dies ist ein Beispiel für eines
der wenigen fluoreszierenden Anthrachinone. Parietin lässt sich leicht durch Extraktion gewinnen, aber auch direkt aus der Flechte
heraussublimieren (siehe Bild). Die Lösung von Parietin in einem Lösungsmittel wie Ethanol ist gelb mit einer gelben Fluoreszenz.
Bei Zugabe einer Base (z. B. wässr. KOH) schlägt die Farbe nach rot um und die Fluoreszenz verschwindet. Mit einer Säure (z. B. HCl)
lassen sich sowohl die ursprüngliche Farbe als auch die Fluoreszenz regenerieren.
Wenn man einmal mit der Suche nach Fluoreszenzfarbstoffen begonnen hat, wird man auch an unerwarteten Stellen fündig.
Eine Gruppe von Lebewesen bei denen Fluoreszenz relativ weit verbreitet ist sind die Pilze. Die meisten Pilze sind wahrscheinlich
überhaupt noch nicht auf etwa auftretende Fluoreszenz untersucht worden. Von der Gattung Russula ist aber schon bekannt dass
sie zahlreiche Arten mit Fluoreszenz hervorbringt. Als Fluoreszenzfarbstoffe treten vor Allem Russupteridine und Russulumazine auf .
Man findet aber auch Arten die durch eingelagertes Riboflavin eine Gelbgrüne Fluoreszenz aufweisen 7. Die Farbstoffe sind recht stabil
und bleiben auch beim Trocknen und Herbarisieren erhalten. Oft treten zwei oder gar mehrere Fluorenzfarben auf. Direkt unter der Huthaut
befindet sich meist eine Schicht mit intensiver hellbauer Fluoreszenz, die Lamellen leuchten oft gelbgrün und mitunter der Stiel
rötlich.
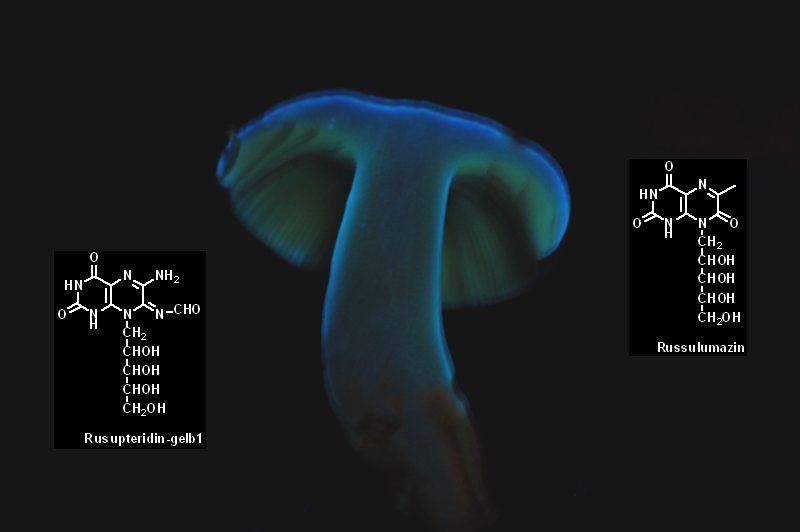
Das Bild zeigt ein aufgeschnittenes Exemplar von Russula sardonia, einem besonders farbenfroh fluoreszierenden Täubling.

Die wohl farbenfroheste Pilzgattung sind wahrscheinlich die Cortinarien. Hier gibt es zahlreiche Arten die so viel Farbstoff
enthalten, dass man sie zum Färben von Textilien verwenden kann. Ich selbst habe ein mit Cortinarius venetus gefärbtes
Seidentuch das auch noch die schöne gelbgrüne Fluoresznenz des darin enthaltenen Dermoxanthons zeigt. Auch der Pilz selbst leuchtet
unter der UV-lampe gelbgrün. Gibt man ein Stückchen Pilz in Ethanol, so löst sich der Farbstoff heraus und die Lösung fluoresziert gelbgrün.
Bei Zugabe einer Base ändert sich die Fluoresznezfarbe von gelbgrün nach blaugrün.
Über die Fluoreszenz von Inskten ist nur wenig bekannt und über die Chemie die sich dahinter verbirgt noch weniger. Dies
mag auch an den in der Vergangenheit stark eingeschränkten Möglichkeiten zur Erzeugung von UV-Licht liegen. In Museumsammlungen hat man
bei 10069 untersuchten Schmetterlingen und Nachtfalten 3122 mit Fluoreszenz gefunden. Das sollte Ansporn genug sein um selber mal
auf die Suche zu gehen.

Es ist schon lange bekannt, dass man in der Wüste bei Nacht Skorpione durch ihre Fluoreszenz aufspüren kann. Hier habe
ich mal einen Rundgang im Garten bei Nacht gemacht und meine UV-Lampe mitgenommen. Dabei habe ich diese Krabbenspinne auf einer
Blüte sitzen sehen. Die Fluoreszenz war sehr hell und das Bild ist ohne Stativ entstanden.

Hier war ich richtig überrascht, ein fluoreszierender Nachtfalter! Es handelt sich um den berüchtigten Buchsbaumzünsler, der
auch meinen Buchsbaum auf dem Gewissen hat. Wie schon bei der Spinne, war auch hier die Fluoreszenz sehr hell und das Bild ist ohne Stativ entstanden.
Fluoreszenz unter Wasser
Lebewesen mit fluoreszierenden Inhaltsstoffen gibt es natürlich nicht nur an Land sondern auch unter Wasser, in Flüssen, Seen und
Ozeanen. Obwohl ich selber gerne tauche und auch Nachttauchgänge mache, konnte ich die wunderbare Fluoreszenz von Unterwasserlebewesen bisher
noch nicht selber sehen. Aber auch hier bieten Meeresaquarien wie z. B. das in Monterey Beobachtungsmöglichkeiten. Das Aquarium in dem die Qualle
auf dem Photo lebt, wurde mit UV-Licht bestrahlt.

Photo: Stefan Schramm, Monterey Bay Aquarium 2013
Um eine schöne Unterwasserfluoreszenz zu sehen, reicht aber auch ein Besuch im Meeresaquarium Zella-Mehlis. Die ausgestellten Korallen sind
wunderschön und teilweise auch mit Fluoreszenz.

Photo: Koralle photographiert im Meeresaquarium Zella-Mehlis
Die Fluoreszenz scheint unter Wasser sogar noch weiter verbreitet zu sein als an Land, ist aber auf Grund der schwierigen
Beobachtbarkeit und der eingeschränkten Sammelmöglichkeiten weniger erforscht. Chlorophyll und Grün Fluoreszierendes Protein (GFP)
sind nachgewiesene Emitter aber vieles ist noch nicht bekannt oder überhaupt mal beobachtet worden. Handelsübliche Blaulichtlampen, z. B. von
TillyTec (Emission 455-465 nm) können diese langwellig absorbierenden
Moleküle anregen, aber für viele andere Fluorophore reicht die Energie nicht. Da blaues Licht auch von uns wahrgenommen werden kann,
wird noch ein Filter vor der Brille oder dem Objektiv benötigt, um die Fluoreszenz zu sehen.
Für Interessenten gibt es eine schöne Seite bei
Diveinside Biologie.
Lit.:
- J. Marshall, S. Johnsen, Fluorescence as a means of colour signal enhancement, Phil. Trans. R. Soc. B 372, 20160335,
Übersichtsartikel in englisch ohne Formeln
- D. Weiß, H. Brandl, Fluoreszenzfarbstoffe in der Natur, Chemie in unserer Zeit (2013), Teil 1: 47, S. 50-54;
- D. Weiß, H. Brandl, Fluoreszenzfarbstoffe in der Natur, Chemie in unserer Zeit (2013), Teil 2: 47, S. 122-131;
- D. Weiß, E. Täuscher, H. Brandl, Die bunte Welt der Porphyrine, Chemie in unserer Zeit (2019) 53, S. 12–21
- B. Achari, P. K. Dutta, S. K. Roy, P. Chakraborty, J. Sengupta, D. Bandyopadhyay, J. K. Maity,
I. A. Khan, Y. Ding, D. Ferreira, J. Nat. Prod. 2012, 75, S. 655-660.
- S. Moser, T. Müller, M.-O. Ebert, S. Jockusch, N. J. Turro, B. Kräutler; Angew. Chem. 120 (2009);
S. Moser, T. Müller, A. Holzinger, C. Lütz, S. Jockusch, N. J. Turro, B. Kräutler; PNAS 15 (2009) 15538-15543
- Vortrag von B. Kräutler in der Leopoldina
- O. Völker, Journal für Ornithologie 1938, 36/3, 436-456
- P. X. Iten, H. Märki-Danzig, H. Koch, C. H. Eugster, Helv. Chim. Acta 1984, 67, 550-569
- K. Tegeler, Leitfaden zum Färben mit Pilzen














 Photo: Stefan Schramm, Monterey Bay Aquarium 2013
Photo: Stefan Schramm, Monterey Bay Aquarium 2013
 Photo: Koralle photographiert im Meeresaquarium Zella-Mehlis
Photo: Koralle photographiert im Meeresaquarium Zella-Mehlis