

Die grundlegenden Abläufe bei der energetischen Angegung von Molekülen und insbesondere bei der Absorption von Licht wurden bereits im Abbschnitt Lumineszenz besprochen. Wie bei der Fluoreszenz auch fehlt es bei der Phosphoreszenz einigen Molekülen an strukturellen Möglichkeiten einen angeregten Zustand thermisch zu deaktivieren. Dafür haben sie aber energetisch günstige (d. h. energieärmer als der S1 Zustand) Energieniveaus, die erreicht werden können, wenn der Spin des Elektrons sich ändert. Dieser Übergang verstößt gegen die Spinauswahlregel , das heist er läuft nur mit einer geringen Wahrscheinlichkeit ab, wobei das Molekül vom Singulett Zustand (S) in den Triplett Zustand (T) übergeht. Dieser Prozess wird neudeutsch als intersystem crossing bezeichnet. Im T1 - Niveau hängt das Elektron erst einmal fest, denn der Übergang in den Grundzustand (S0) ist zwangsläufig wieder mit einer Spinumkehr verbunden und damit ebenfalls verboten. Die Lebensdauer des T1 Zustandes ist deshalb auch deutlich höher als die des S1 Zustandes und reicht von Millisekunden bis zu mehreren Stunden und sie kann in einigen Fällen auch Jahrtausende betragen. Letztlich erfolgt aber auch hier eine Desaktivierung zum Grundzustand, entweder thermisch oder durch Emission eines Photons, d. h, durch Abgabe von Licht. Das bei der Desaktivierung des Triplett - Zustandes abgestrahlte Licht wird als Phosphoreszenzlicht bezeichnet, die Erscheinung als Phosphoreszenz. Eine Übersicht über diese Prozesse und Zusammenhänge gibt das Jablonski - Diagramm.
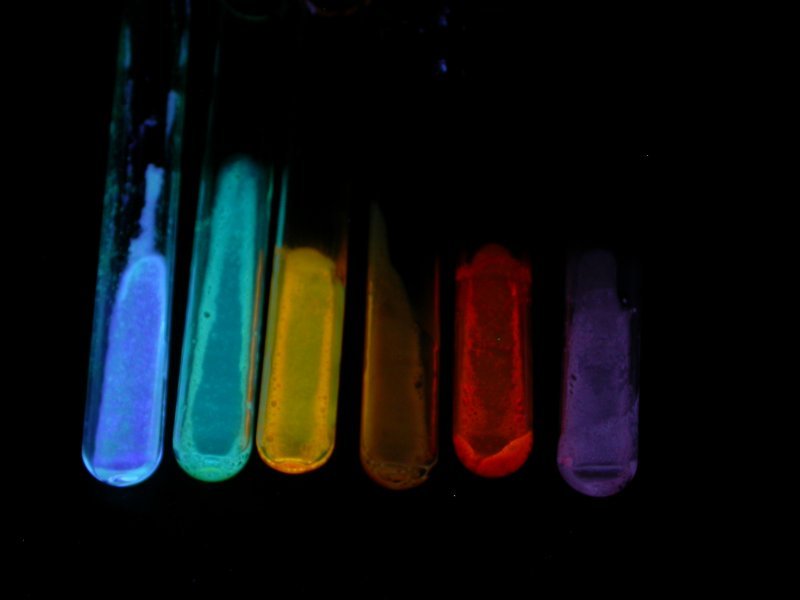
Praktisch bedeutet dies, dass die Phosphoreszenz oft nur schwer zu beobachten ist. Für Messungen friert man z. B. Molekülschwingungen, die zu einer thermischen Desaktivierung angeregter Zustände führen, ein, indem man bei sehr tiefen Temperaturen arbeitet. Eine weitere Methode ist es die Viskosität der Umgebung zu erhöhen. Fluorescein ist ein bekannter und leicht herstellbarer Fluoreszenzfarbstoff, seine Phosphoreszenz bekommt man aber praktisch nie zu sehen. Man kann Fluorescein aber mit Borax zusammen zu einer festen, glasartigen Masse schmelzen, dann kann man eine einige Sekunden anhaltende Phosphoreszenz beobachten. Ein analoges und weniger giftiges Experiment kann man auch mit geschmolzener Weinsäure als Matrix für das Fluorescein machen. Leider lösen sich nicht alle Fluoreszenzfarbstoffe in der Weinsäureschmelze auf. Die sich lösen zeigen dafür eine ausgesprochen brilliante Fluoreszenz und oft auch eine wenige Sekunden andauernde Phosphoreszenz. Zur Beobachtung der Phosphoreszenz lohnt es sich die Reagenzgläser einige Zeit im Tiefkühlschrank zu lagern und die Beobachtung bei möglichst tiefen Temperaturen zu machen.
Eines der wenigen Moleküle die von Natur aus im Triplett Zustand vorliegen ist der molekulare Sauerstoff 3O2. Da die Wechselwirkung von Tripletts untereinander ein erlaubter Prozess ist, führt die Anwesenheit von Sauerstoff oft zu einer Verringerung oder gar Löschung der Phosphoreszenz.
Die Phosphoreszenz von anorganischen Stoffen ist schon seit Jahrhunderten bekannt.Es gibt zahlreiche, natürlich vokommende Mineralien die phosphoreszieren. Das erste synthetische, phosphoreszierende Material war der Lapis Solaris oder auch Bologneser Leuchtstein genannte Stoff den der Schuster und Alchemist Vicento Cascariolo 1604 in Bologna hergestellt hat. Mit der Entwicklung von Leuchtstoffröhren, Monitoren und Fernsehbildröhren hat die Entwicklung von phosphoreszierendem Material einen gigantischen Aufschwung genommen und es wurden zahlreiche phosphoreszierende Materialien entwickelt. Auch die Laser Technik beruht letztlich auf der Phosphoreszenz weil auch hier Triplett-Zustände erzeugt und auf dem T1 Niveau gefangen und angereichert werden. Das technologische Prinzip der Phosphoreszenzfarbstoffe ist immer das Gleiche; in eine kristalline oder glasartige Matrix werden Fremdionen eingebettet (Dotierung) die für die Emission verantwortlich sind. Cascariolo stellte durch Reduktion von Bariumsulfat zu Bariumsulfid eine geeignete Matrix her. Die eigentliche Emission erfolgte durch Kupferionen die, in genau der richtigen Konzentration, aus dem Reduktionsmittel (Holzkohle gemischt mit Roggenmehl) stammen.

Die Sufide zweiwertiger Metallionen (Ca2+, Sr2+, Ba2+, Zn2+) stellen auch heute noch wichtige Matrices für phosphoreszierende Materialien dar, die sich relativ leicht herstellen lassen. Komplizierter und technisch aufwendiger herzustellen aber mit noch höheren Lichtintensitäten und Leuchtdauern sind die Leuchtphosphore auf der Basis von Aluminaten, insbesondere die von Strontiumaluminat. Die Dotierung erfolgt hier mit Seltenerdmetallen wie z. B. Europium mit einer schönen roten Phosphoreszenz. Solche Leuchtphosphore können relativ kostengünstig bei verschiedenen Internetanbietern erworben werden.
Wenn man sich für so was interessiert hinterlässt das auch Spuren im privaten Bereich. So habe ich natürlich nicht einfach nur Badelatschen sondern echte Havaianas, natürlich mit Phosphoreszenz
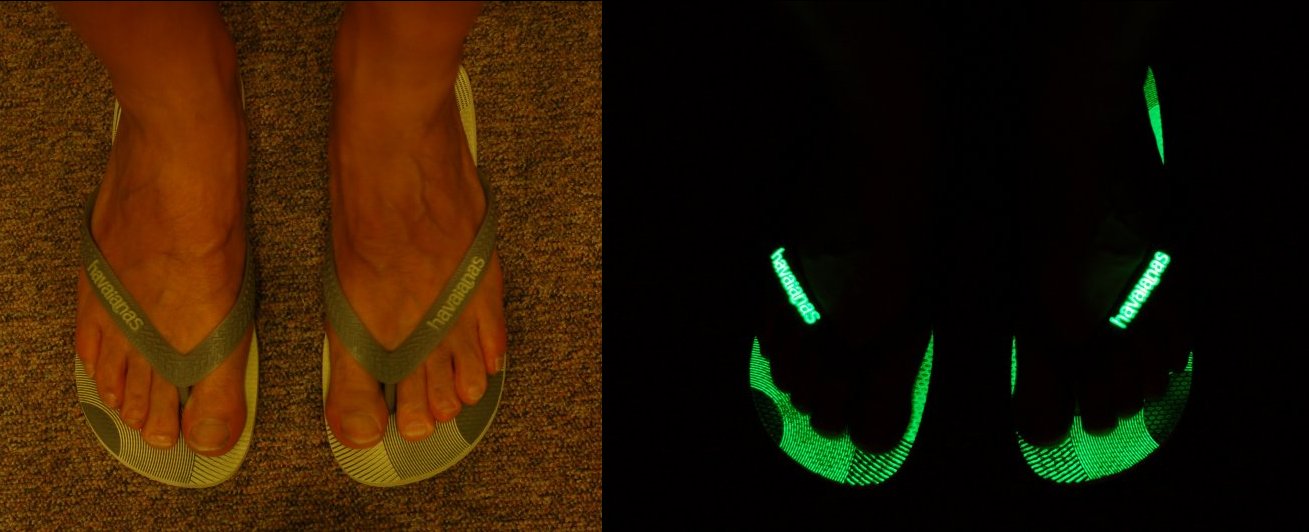



.
Literatur: